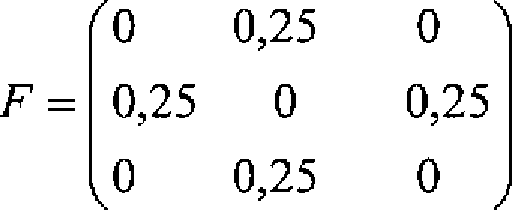-
Die vorliegende Erfindung betrifft ein Verfahren zur Bestimmung einer MR-systembedingten Phaseninformation eines Phasenwertes in einem MR-Phasenbilddatensatz und eine MR-Anlage, mit der die MR-systembedingte Phaseninformation berechnet werden kann.
-
Die Phasenbildgebung hat in der Magnetresonanztomographie (MRT) ein breites Anwendungsgebiet. Die in dem MR-Signal enthaltene Phaseninformation kann beispielsweise in der suszeptibilitätsgewichteten MRT, Phasenkontrast-MRT, zur Flussmessung, zur Bestimmung des Fettgehaltes in einem Gewebe und zur Thermometrie verwendet werden. Bei Thermometrie oder Thermotherapieverfahren wird die Temperatur in Tumorzellen gezielt erhöht, um die Zellen abzutöten oder die Tumorzellen empfindlicher für begleitende Therapiemaßnahmen, wie die Chemo- oder Strahlentherapie, zu machen. Die Gewebeerwärmung kann hier beispielsweise durch Laser oder Ultraschall oder HF-Antennen erfolgen. Um das gesunde Gewebe durch die erhöhte Temperatur nicht zu stark zu belasten, ist eine Temperaturüberwachung des erhitzten Gewebes erforderlich. Die MRT hat durch die Temperaturabhängigkeit einiger MR-Parameter, wie der chemischen Verschiebung, das Potential, Temperaturänderungen nicht-invasiv darzustellen. Bei der auf der Temperaturabhängigkeit der chemischen Verschiebung basierenden Temperaturüberwachung wird die durch die Temperaturerhöhung geänderte Resonanzfrequenz in einer geänderten Phasenlage im Bildpunkt detektiert. Da jedoch die Temperaturabhängigkeit mit –0,01 ppm/°C gering ist, ist es wichtig, die durch die MR Anlage bedingte Phaseninformation bzw. die durch die MR Anlage bedingte Phasenänderung zu kennen, damit die aus der Phaseninformation bestimmte Temperaturinformation nicht verfälscht wird. Bei der Temperaturbildgebung basierend auf der chemischen Verschiebung können nur Temperaturänderungen dargestellt werden durch Berechnen von Phasenänderungen. Auch hierbei ist es wichtig, die systeminduzierte Phasenänderung von der temperaturinduzierten Phasenänderung zu trennen. Die über die Zeit bestehende Phasendrift aufgrund der Änderung des B0-Feldes kann beispielsweise über Referenzbildpunkte bestimmt werden, die nicht erhitzt werden. Bei dieser Differenzbildung von zeitlich getrennt aufgenommenen Phasendatensätzen kann es auftreten, dass der Patient sich zwischen den Messungen bewegt oder sich die magnetische Umgebung ändert.
-
Ein Problem bei der Verwendung einer Phaseninformation ist die Präsenz von Wasser und Fettmolekülen in einem Gewebe. Erstens unterscheidet sich die Resonanzfrequenz von Fett und Wasser um ca. 3,5 ppm und zweitens ist die chemische Verschiebung von Fett nicht temperaturabhängig. Bei einem nach Dixon benannten Verfahren wird die durch B0-Feld-Inhomogenitäten erzeugte Phasendrift abgeschätzt, um Fett von Wasser zu trennen. Die Standardvoraussetzung bei der Dixon-Fett-Wasser-Trennung besteht darin, dass das Signal in einem Voxel durch zwei verschiedene Populationen erzeugt wird, Fettmoleküle und Wassermoleküle. Wenn der Fettanteil als r bestimmt wird, so liegt der Wasseranteil bei (1 – r), wobei r zwischen 0 und 1 liegt. Jedes Molekül hat seine eigene Winkelfrequenz ωfat für Fett und ωwater für Wasser. Aufgrund der unterschiedlichen Resonanzfrequenz liegen die Signalanteile der beiden Moleküle in Abhängigkeit von der Echozeit entweder in Phase oder gegen Phase.
-
Weiterhin sind sogenannte referenzlose Verfahren zur Erstellung von Phasenbilddatensätzen bekannt, bei dem die systembedingte Phaseninformation nicht in einem zusätzlichen Referenzobjekt gemessen wird.
-
Bei Verfahren mit Referenzobjekten kann das Referenzobjekt beispielsweise der Patient selber sein, wobei ein Referenzdatensatz vor der Erhitzung gemessen wird. Bei der Flussmessung kann ein Fluss kodierender Gradient an- und abgeschaltet werden. Bei Flussmessungen wird oft ohne Referenzobjekt gemessen. Bei diesen referenzlosen Ansätzen wird davon ausgegangen, dass sich die MR-systembedingte Phaseninformation über das Gesichtsfeld des Bildes nur langsam ändert, so dass, wenn eine verlässliche Phaseninformation in einigen Bildpunkten bekannt ist, die MR-systembedingte Phasenänderung durch Interpolation, beispielsweise durch ein Polynom niedriger Ordnung, angenähert werden kann. Hierfür ist jedoch die Auswahl von validen Phasenreferenzpunkten notwendig, auf Grundlage derer die Phasenentwicklung über das Bild angenähert werden kann. Hierbei ist es also notwendig zwischen validen Bildpunkten und anderen Bildpunkten zu unterscheiden, bei denen der MR-anlagenbedingte Phaseneinfluss abgeschätzt werden muss.
-
Diese Einteilung in valide und nicht valide Bildpunkte ist schwer durchzuführen, da Bildpunkte gefunden werden müssen, bei denen das Gewebe weder erhitzt wurde, noch eventuelle Fett-Wasser-Kombination die Phaseninformation verfälschen.
-
Es ist daher Aufgabe der vorliegenden Erfindung ein Verfahren bereitzustellen, mit dem es möglich ist, eine räumliche MR-systembedingte Phasenänderung bzw. Phaseninformation in einem MR-Phasenbilddatensatz zu bestimmen.
-
Diese Aufgabe wird mit den Merkmalen gemäß der unabhängigen Ansprüche gelöst. In den abhängigen Ansprüchen sind bevorzugte Ausführungsformen der Erfindung beschrieben.
-
Gemäß einem ersten Aspekt der Erfindung wird ein Verfahren zur Bestimmung einer MR-systembedingten Phaseninformation eines Phasenwertes in einem MR-Phasenbilddatensatz bereitgestellt, wobei in einem ersten Schritt der Erfindung zu den einzelnen Bildpunkten eines ersten Phasenbilddatensatzes Anfangsvarianzen zugeordnet werden. Dies bedeutet, dass zu möglichst vielen Bildpunkten in einem dargestellten Untersuchungsbereich Anfangsvarianzen bestimmt werden. In einem weiteren Schritt werden zur Erstellung eines weiteren Phasenbilddatensatzes ein Phasenwert und eine Varianz des Phasenwertes für die Bildpunkte des weiteren Phasenbilddatensatzes abgeschätzt, indem der erste Phasenbilddatensatz einer linearen Transformation unterzogen wird und anschließend wird der weitere Phasenbilddatensatz durch gewichtete Addition der Phasenwerte des ersten Phasenbilddatensatzes mit den abgeschätzten Phasenwerten berechnet, wobei die Gewichtung der beiden Phasenwerte bei der Addition in Abhängigkeit von der, zu dem jeweiligen Phasenwert gehörigen Varianz erfolgt. Durch die lineare Transformation werden die Phaseninformationen in den Bildpunkten des ersten Phasenbilddatensatzes auf die Phasenwerte des weiteren Bilddatensatzes übertragen. Die in den einzelnen Bildpunkten enthaltenen Phaseninformationen haben jedoch selbst eine bestimmte Unschärfe bzw. Ungenauigkeit, die durch die Varianz ausgedrückt wird. Bei der Berechnung des weiteren Bilddatensatzes bzw. bei der Berechnung der Phasenwerte des weiteren Bilddatensatzes werden nun die Phaseninformationen des ersten Bilddatensatzes und die Phaseninformationen des weiteren Phasenbilddatensatzes in Abhängigkeit von der Varianz gewichtet, die in dem jeweiligen Bildpunkt vorliegt.
-
Vorzugsweise wird hierbei die Gewichtung eines Phasenwertes bei der Addition umso höher, je niedriger die zu dem Phasenwert gehörige Varianz ist. Umgekehrt ist die Gewichtung eines Phasenwertes bei der Addition niedriger, wenn die zugehörige Varianz des Phasenwertes hoch ist. Anders ausgedrückt werden Phaseninformationen, bei denen der Phasenwert mit hoher Genauigkeit bestimmt werden kann, hoch gewichtet, während Phasenwerte, bei denen keine genaue Aussage über die Phaseninformation möglich ist, niedrig gewichtet werden. Anstelle der Auswahl von Referenzbildpunkten, denen eine gesicherte Phasenlage zugeordnet werden kann und Extrapolation der Phaseninformation auf die Bildpunkte, für die keine gesicherte Phaseninformation vorliegt, werden erfindungsgemäß die Bildpunkte in Abhängigkeit von ihrer Ungenauigkeit bzw. Varianz berücksichtigt.
-
Gemäß einer bevorzugten Ausführungsform der Erfindung weist der erste Phasenbilddatensatz bei der Zuordnung der Anfangsvarianzen eine erste Gruppe von Bildpunkten auf, bei denen die Varianz im Wesentlichen von einem Signal-zu-Rauschverhältnis des MR Signals abhängt, mit der der erste Phasenbilddatensatz erzeugt wurde. Dabei kann die Signalstärke, d. h. das Betragssignal im Verhältnis zum Rauschen betrachtet werden. Weiterhin ist vorzugsweise eine zweite Gruppe von Bildpunkten vorgesehen, bei der die Varianz mit Hilfe eines Modells bestimmt wird, das dem jeweiligen Bildpunkt zugrunde gelegt wird und mit dessen Hilfe eine Varianz in diesem Bildpunkt bestimmt wird. Wie später im Detail näher erläutert wird, kann die Varianz der Bildpunkte der zweiten Gruppe beispielsweise mit Hilfe eines Modells bestimmt werden, das berücksichtigt, welche Bildpunkte erhitzt werden, wie das Fett/Wasser-Verhältnis in einem Bildpunkt ist, wie sich die Suszeptibilität des Gewebes in dem Bildpunkt verhält etc.
-
Bevorzugterweise wird die varianzabhängige Addition und die Berechnung des weiteren Phasenbilddatensatzes iterativ wiederholt durch Addition der Phasenwerte eines Phasenbilddatensatzes im Iterationsschritt i je –1 und den Phasenwerten des Phasenbilddatensatzes bei Iterationsschritt i. Diese Iteration kann bis zur Erstellung eines finalen Phasenbilddatensatzes wiederholt werden, der dann der MR systembedingten räumlichen Phaseninformation entspricht. Bei den Iterationsschritten werden die Phasenbilddatensätze solange der linearen Transformation unterzogen, bis sie sich einer endgültigen räumlichen Phasenverteilung über das Bild annähern, die dann der systembedingten Phaseninformation bzw. Phasenentwicklung entspricht. Wenn der Unterschied in den Phasenbilddatensätzen zwischen zwei Iterationsschritten kleiner als ein vorbestimmter Grenzwert ist, ist dieser finale Bilddatensatz erreicht.
-
Die lineare Transformation kann durch Faltung des ersten Phasenbilddatensatzes mit einem Filterkernel erfolgen. Bei Filterung mit einem Filterkernel wird eine Kernelmatrix auf jeden Bildpunkt des Bildes angewandt, wobei der Kernel Multiplikationsfaktoren beinhaltet, die auf den Bildpunkt selbst und seine Nachbarn angewandt werden. Die Summe der Produkte der Bildpunktwerte mit den entsprechenden Matrixelementen ersetzt dann den Wert in einem Bildpunkt. Ein beispielhafter Filterkernel ist z. B. eine Drei-mal-drei-Matrix mit Nullen in den Diagonalelementen und mit den Werten ein Viertel in den übrigen vier Matrixelementen. Selbstverständlich sind viele andere Filterkernel denkbar, die eine lineare Transformation bilden.
-
Ebenso ist es möglich, dass der weitere Phasenbilddatensatz durch Faltung mit mehreren verschiedenen Filterkerneln und den zugehörigen Varianzen abgeschätzt wird, wobei die sich durch die Faltung mit den Filterkerneln ergebenden Phasenwerte bei der Addition jeweils in Abhängigkeit von der zugehörigen Varianz gewichtet werden können. Insbesondere in Fällen, in denen nicht klar ist, welcher Filterkernel verwendet werden soll, ist es möglich, verschiedene Filterkernel anzuwenden, und die Ergebnisse in Abhängigkeit von der zugehörigen Varianz zu gewichten. Da es schwierig sein kann, im Vorhinein zu bestimmen, welche Art von Filterkernel verwendet werden soll, beispielsweise ob es ein interpolierender Filterkernel oder ein extrapolierender Filterkernel sein soll, bietet diese Ausführungsform mit der Verwendung mehrerer Filterkernel den Vorteil, die verschiedenen Filterkernel zu verwenden und die Ergebnisse in Abhängigkeiten ihrer Varianzen zu gewichten. Die Anfangsvarianzen sind unabhängig von den verwendeten Kerneln. Verschiedene lineare Transformationen kombinieren diese Phasen jedoch unterschiedlich, wodurch sich dann auch unterschiedliche Varianzen in den jeweiligen z. B. gefalteten Ergebnissen ergeben. Beispielsweise kann es sein, dass ein Filterkernel einen Punkt mit einer sehr hohen Varianz (oder einem invaliden Bildpunkt) verwendet, dann ist das Ergebnis negativ belastet, was sich durch eine hohe Ergebnisvarianz zeigt.
-
Nachfolgend werden einige Ausführungsbeispiele erläutert, wie Anfangsvarianzen in Bildpunkten zugeordnet werden können. Falls in einem Bildpunkt nur Wassermoleküle enthalten sind und keine Fettmoleküle, so hängt hier die Phasenvarianz in diesem Bildpunkt von der Größe des Signals bzw. dem Signal-zu-Rausch-Verhältnis des Signals ab. Aus diesem Grund kann sich die Varianz in den Phasendaten von Bildpunkt zu Bildpunkt ändern.
-
Üblicherweise wird nur eine Messung der Phasen vorliegen, sodass keine Varianz direkt auf statistischem Wege von den Daten erhoben werden kann. Der hier angestrebte Ansatz basiert auf der Kenntnis des Signal-zu-Rauschverhältnisses des Bildpunktes. Die Größe des Signals ist die Magnitude. Das Rauschen kann auf Basis von mehreren Methoden geschätzt werden. Einige dieser Methoden beruhen darauf, dass das Rauschen in komplexen MR-Daten im Idealfall für alle Bildpunkte die gleiche Gaußsche Statistik aufweist. Somit lässt es sich besonders gut in Regionen ohne Signal, d. h. im Hintergrund oder in homogenen Gebieten schätzen. Alternativ dazu kann eine Rauschmessung vorgenommen werden, indem beispielsweise das Signal ohne Anregungspuls gemessen wird. Da sich das Rauschverhalten zwischen Messungen auf vorhersagbare Weise ändert, beispielsweise durch die Bandbreite oder die k-Raumabtastung, müssen Rauschmessungen nicht konstant wiederholt werden. Auch bei paralleler Empfangsbeschleunigung und nicht kompletter k-Raumabtastung lässt sich die räumliche Modulierung der Varianzen vorhersagen. Berechnet man durch einen Logarithmus aus einem MR-Signal (x) mit Gauß'schem Rauschen und einer Kovarianzmatrix ”C” eine Phase, so hat diese berechnete Phase eine (Laplace-genäherte) Kovarianz ”D”, deren Inverse sich aus den folgenden Matrix-Elementen errechnet: [D–1]nm = (xmxn*[C–1]nm + xm*xn[C–1]mn)/2
-
Im Falle einer räumlich (oder spektral) unabhängigen Rauschverteilung (weißes, Gauß'sches Rauschen) sind die Matrizen ”C” und ”D” diagonal und durch folgende Formel verwandt: [D–1]nn = xnxn*[C–1]nn
-
Die Signalabhängigkeit der Varianz kann auch in Bildpunkten verwendet werden, bei denen auch Fettgewebe in den Bildpunkten enthalten ist, jedoch der Fettsignalanteil beispielsweise durch Fettunterdrückung unterdrückt worden ist, oder mit Hilfe des Dixon-Verfahrens bestimmt wurde.
-
Enthält ein Bildpunkt vorwiegend Fettgewebe, so kann die Anfangsvarianz beispielsweise unter Berücksichtigung des fettinduzierten Phasenwinkels und des gemessenen Phasenwinkels in diesem Bildpunkt bestimmt werden. In Bildpunkten mit überwiegend Wassergewebe kann wie oben erwähnt die Signalintensität des Signalbetrages in diesem Bildpunkt zur Bestimmung der Anfangsvarianz verwendet werden. Ist das Gewebe in einem Bildpunkt, für den eine Anfangsvarianz bestimmt werden soll, gegenüber dem umliegenden Gewebe erwärmt worden, so kann auch die durch die Erwärmung induzierte Phasenänderung bei der Bestimmung der Varianz berücksichtigt werden. Die durch die Erwärmung induzierte Phasenänderung kann beispielsweise verwendet werden, um eine maximale Phasenänderung zu bestimmen und diese beispielsweise als Mindeststandardabweichung zu verwenden. wenn der erwärmte Bereich bekannt ist, kann über ein Temperaturmodell beispielsweise die Höchsttemperatur in der Umgebung verwendet werden, um aus der höchsten Temperatur auf eine maximale temperaturinduzierte Phasenänderung zu schließen.
-
Bei der zweiten Gruppe von Bildpunkten, bei denen die Varianz mit Hilfe eines Modells bestimmt werden soll, können Bildpunkte enthalten sein, die keine verlässliche Phaseninformation beinhalten, für die jedoch eine Phaseninformation und eine Varianz durch die lineare Transformation abgeschätzt werden soll. Diese zweite Gruppe kann weiterhin Bildpunkte enthalten, für die durch die lineare Transformation kein Phasenwert abgeschätzt werden soll. Für Bildpunkte außerhalb des Körpers, oder Bildpunkte innerhalb von Gefäßen oder Implantaten, hat der Phasenwert in dem Bildpunkt keine Information, die einer langsamen Änderung über die Bildebene entspricht. Für diese Bildpunkte ist es beispielsweise vorteilhaft, keinen Phasenwert und keine Varianz abzuschätzen, und im Falle der Iteration kann die Varianz dieser Bildpunkte zwischen den Iterationsschritten wiederum als unbekannt gesetzt werden, damit die Phasenwerte in diesen Bildpunkten die Phasenwerte in anderen Bildpunkten, in denen ein Phasenwert abgeschätzt werden soll, nicht bei der linearen Transformation beeinflussen. Diese Bildpunkte können beispielsweise durch eine sehr hohe Varianz als „unbekannt” gesetzt werden.
-
Ebenso ist es möglich, Phasenbilddatensätze, die durch verschiedene lineare Transformationen abgeschätzt wurden, miteinander zu vergleichen. Die mit verschiedenen linearen Transformationen erzeugten Phasenbilddatensätze sollen jeweils nach der Iteration den finalen Phasenbilddatensatz ergeben, der die systembedingten Phasenwerte in den Bildpunkten widerspiegelt. Ist der Unterschied zwischen zwei finalen Bilddatensätzen größer als ein Grenzwert, der sich aus den Varianzen ergeben kann, so kann beispielsweise eine Fehlermeldung generiert und angezeigt werden. In einer Ausführungsform kann die wie oben beschrieben bestimmte MR-systembedingte Phaseninformation zur Berechnung eines Temperaturwertes in einem Bildpunkt verwendet werden, der mit Hilfe der Phasenwerte des MR-Phasenbilddatensatzes bestimmt wird.
-
Bei Bildpunkten, bei denen die Anfangsvarianz im Wesentlichen mit Hilfe der Signalintensität in dem zugehörigen Bildpunkt berechnet wird unter Berücksichtigung der Signalintensität eines Hintergrundsignals, kann bei der Berechnung ein Laplace-Näherungsverfahren auf die komplexen MR Signale angewandt werden.
-
Die Erfindung betrifft ebenso eine MR-Anlage, mit der das oben genannte Verfahren durchgeführt werden kann. Insbesondere weist die MR Anlage eine Rechnereinheit auf, die die varianzabhängige Addition der Phasenbilddatensätze durchführt.
-
Die Erfindung wird durch nachfolgende Bezugnahme auf die beiliegenden Zeichnungen näher erläutert. Hierbei zeigen:
-
1 schematisch eine MR Anlage, mit der eine MR systembedingte Phaseninformation berechnet werden kann, und
-
2 ein Flussdiagram zur Durchführung der Berechnung der MR anlagebedingten Phaseninformation.
-
In 1 ist eine MR Anlage 10 dargestellt mit einem Magneten 11 zur Erzeugung eines B0-Feldes, in den eine Untersuchungsperson 12 eingeschoben werden kann, die auf einer Liege 13 angeordnet ist. Die gezeigte MR Anlage kann beispielsweise für eine Thermotherapie verwendet werden, bei der einzelne Bereiche des Körpers der Untersuchungsperson erhitzt werden, um im erhitzten Bereich lokalisiertes Tumorgewebe zu zerstören. Mit Aufnahme von MR Signalen und der Erstellung von Phasenbildern kann die Temperaturentwicklung in der Untersuchungsperson nicht invasiv zwei- oder dreidimensional überprüft werden, indem beispielsweise Gradientenechosequenzen mit einer vorbestimmten Echozeit TE verwendet werden, um in einer Phasenänderung Δϕ auf eine Temperaturänderung ΔT zu schließen. Die MR Anlage 10 weist eine zentrale Steuereinheit 14 auf, mit der die MR Anlage gesteuert werden kann. Nachfolgend werden nur einige wenige Komponenten der MR Anlage beschrieben, da es dem Fachmann allgemein bekannt ist, wie durch Einstrahlen von HF Pulsen durch eine HF Steuereinheit 15 und gleichzeitig im Schalten von Gradientenpulsen durch eine Gradientensteuereinheit 16 ein MR Bild erzeugt werden kann durch Detektion des MR Signals. In einer Sequenzsteuerungseinheit 17 wird die Abfolge der Einstrahlung der HF Pulse und der Schaltung der Gradienten gesteuert. In einer Recheneinheit 18 kann dann das MR Intensitätsbild bzw. MR Phasenbild berechnet und auf einer Anzeige 19 dargestellt werden. Über eine Eingabeeinheit 20 kann eine Bedienperson die Auswahl und Eingabe einer Bildgebungssequenz steuern. In der Recheneinheit 18 kann weiterhin die Phase berechnet werden, die durch die MR Anlage bzw. die B0-Instabilität bedingt ist.
-
Bei der Temperaturbildgebung mittels der chemischen Verschiebung wird eine Temperaturänderung ΔT als Phasenänderung Δϕ detektiert, wobei folgender Zusammenhang zwischen Δϕ und ΔT besteht: Δϕ = γB0αΔT·TE (1) wobei TE die Echozeit der Bildgebungssequenz ist, γ das geometrische Verhältnis und B0 die Feldstärke und α die Temperaturabhängigkeit der chemischen Verschiebung ist, die –0,01 ppm/°C beträgt. Die sich aus dem MR Signal ergebende Phaseninformation kann jedoch auch in anderen Gebieten von Bedeutung sein, beispielsweise bei der suszeptibilitätsgewichteten MRT, bei der Phasenkontrast MRT oder bei der Flussmessung mittels Phasenkodierung.
-
Bei allen Anwendungen, die ihre Grundlage in der Phaseninformation haben, ist es von Bedeutung, die beispielsweise durch eine B0-Instabilität induzierte Phasenänderung zu kennen. Weiterhin ist es wichtig, die Phasenentwicklung über das Bild zu kennen, die unabhängig von der gewählten Bildgebungssequenz und der Echozeit induziert wird, beispielsweise durch den Empfangszweig oder durch räumliche B0-Inhomogenitäten.
-
In 2 ist ein Verfahren dargestellt, mit der die systembedingte räumliche Phasenentwicklung über das Gesichtsfeld der MR Anlage bestimmt werden kann. Nach dem Start des Verfahrens in Schritt 21 werden in Schritt 22 Originalphasendaten aufgenommen, d. h. es wird ein MR Datensatz aufgenommen und in jedem Bildpunkt die Phase des detektierten MR Signals dargestellt. Neben der Phaseninformation kann auch die Betragsinformation des MR Signals, wie dem Fachmann geläufig ist, durch Betragsbildung des Imaginär- und Realteils des aufgenommenen Signals gebildet werden. Wenn die Originalphaseninformationen in den einzelnen Bildpunkten bekannt sind, so können in Schritt 23 den einzelnen Bildpunkten Anfangsvarianzen zugeordnet werden. Hierbei werden die Unsicherheiten in den Originalphasendaten und die Unsicherheiten eines Modells berücksichtigt, das für die Bestimmung der Varianzen in den einzelnen Bildpunkten aufgestellt bzw. verwendet wird.
-
Der in Schritt
22 gemessene Phasenbilddatensatz enthält Bildpunkte mit einer relativ gut definierten Unsicherheit, wobei dieser Originalphasendatensatz auch Bildpunkte enthält, bei denen aufgrund eines Modells eine a priori Information verwendet wird, um die Varianzen zu bestimmen. Enthalten die Bildpunkte beispielsweise nur Anteile von Wasser und kein Fett, so kann die Varianz in diesen Bildpunkten in Abhängigkeit von dem Betrag des Signals in diesem Bildpunkt bestimmt werden. Ist das Betragssignal eher hoch, so wird die Varianz eher klein sein, während bei einem geringen Signalbeitrag in einem Bildpunkt die Varianz erhöht sein wird. Da sich die Signalintensität von Bildpunkt zu Bildpunkt ändert, ändert sich auch die Varianz von Bildpunkt zu Bildpunkt. Beispielsweise kann mit der Signalintensität des MR Betragsignals und der Signalintensität des Hintergrundsignals eine Anfangsvarianz für diese Bildpunkte berechnet werden. Eine Ausführungsform hierbei ist die Anwendung des Laplace-Näherungsverfahrens auf die komplexen MR Signale unter Berücksichtigung der Fehlerfortpflanzung von Gaußschen Fehlern. Hierbei wird im Wesentlichen der Einfluss eines Fehlers in ”x” auf eine aus ”x” berechneten Größe ”y” durch eine (gegebenenfalls multidimensionale) Taylordarstellung abgeschätzt. Falls es möglich ist, das Fettsignal in diesen Bildpunkten zu unterdrücken oder den Anteil des Fettsignals zu berechnen, so gilt dies auch für Bildpunkte, die Fett enthalten. Wie bekannt, kann der Fett/Wasseranteil in einem Bildpunkt über das Dixon-Verfahren bestimmt werden. Bildpunkte, die im Wesentlichen Fett enthalten, können auch mit Hilfe von Segmentierungsalgorithmen identifiziert werden, neben dem bekannten Dixon-Verfahren. Bei Bildpunkten, die nur Fett enthalten, kann die systembedingte Phasenänderung nicht von der Phasenänderung aufgrund beispielsweise einer Temperaturänderung getrennt werden. Da Fett jedoch keine temperaturabhängige Phasenänderung hat, kann eine Phasenänderung in Fett abgeschätzt werden mit ω
fat × τ
n. Der Mittelwert und die Varianz der systeminduzierten Phase lauten:
-
ωmeasured ist hier die gemessene Frequenz, ωΔB0 ist die systembedingte Frequenzänderung, wodurch sich die Varianz der systembedingten Frequenzänderung aus der Varianz der gemessenen Frequenz und der Varianz der abgeschätzten Fettfrequenz ergibt.
-
Sind Bildpunkte vorhanden, die im Wesentlichen Fett enthalten, so können die Fettbildpunkte als temperaturunabhängige Referenzphase verwendet werden, so dass es möglich ist, die systembedingte Abweichung der Resonanzfrequenz zu bestimmen. Falls Phasen in Körperbereichen bestimmt werden sollen, die erhitzt werden, so kann die durch die Erhitzung induzierte Phasenänderung bei der Bestimmung der Anfangsvarianz berücksichtigt werden nach obiger Gleichung 1. Hierfür ist es jedoch notwendig, eine ungefähre Information über die Temperaturänderung in den einzelnen Bereichen zu haben. Weiterhin werden in dem Originalphasendatensatz Bildpunkte identifiziert, für die keine Varianz und keine Phaseninformation auf Grundlage eines Modells bestimmt werden soll, beispielsweise bei Bildpunkten, die Gefäße enthalten oder bei Bildpunkten, bei denen die Suszeptibilität sich stark von der der umliegenden Gewebe unterscheidet. Bei Geweben mit geringfügigen Suszeptibilitätsunterschieden ist der Varianzwert zwar unbekannt, soll aber durch die Iteration und die lineare Transformation wie nachfolgend erklärt wird, berechnet werden. Bei Bildpunkten außerhalb des Körpers oder in Gefäßen, Implantaten folgt die Phaseninformation nicht der vorausgesetzten harmonischen Feldentwicklung eines sich gering ändernden Feldes, so dass es hier vorteilhaft ist, die Varianz nicht zu berechnen bzw. nach jeder Berechnung in der Iteration wieder als unbekannt vorauszusetzen.
-
Wenn die Varianzen in den einzelnen Phasenbildpunkten zugeordnet sind, so ist es möglich, in Schritt
24 die Phasenwerte und die Varianz abzuschätzen durch eine lineare Transformation. Diese lineare Transformation kann durchgeführt werden durch Multiplikation des Originalphasendatensatzes mit einem Filterkernel. Ein beispielhafter Filterkernel kann sein:
-
Selbstverständlich können auch andere Filterkernel wie beispielsweise Gauß'sche Filterkernel verwendet werden. Wenn ein Filterkernel mit Gewichtungen w auf einen Phasendatensatz si-1 angewandt wird, wo werden die Originalphasendaten durch die gewichtete Summe von w × si-1 ersetzt, wobei das x einer Faltung entspricht. Der Index i entspricht dem Iterationsschritt während der Iteration, wie nachfolgend näher erläutert wird. Um die Originaldaten zu berücksichtigen wird eine binäre Maske m und eine inverse Maske m verwendet. Durch Transformation der Daten kann die Faltung als Multiplikation dargestellt werden, so dass Folgendes gilt: si = msi-1 + mw⊗si-1 ⇒ Ii = MIi-1 + MWIi-1 (3)
-
Erfindungsgemäß wird nun anstelle von 0 und 1 für die Werte von m bzw. m jeder Wert in Abhängigkeit von der Varianz eines jeden Wertes berücksichtigt nach folgender Gleichung: si = ((v0)–1 + (v i / ws)–1)–1((v0)–1s0 + (v i / ws)–1w⊗si-1)
⇒ Ii = ((V0)–1 + (V i / WI)–1)–1((V0)–1I0 + (V i / WI)–1WIi-1) (4) wobei s0 und v0 die Originalphaseninformation und die dazugehörige Varianz ist, si-1 die Phaseninformation von der vorherigen Iteration und v i / ws die Varianz der mit dem Kernel gefalteten Daten sind. Nach der vorherigen Transformation ergibt sich die obige Gleichung 4 mit entsprechenden Größen I0, V0, Vi-1 und V i / wi . Wie aus obiger Gleichung 4 zu erkennen ist, wird der Ausgangsphasenwert mit der Ausgangsvarianz gewichtet. Der Term in der ersten großen Klammer mit V0 und V i / wi dient zur Normierung. Die Größe I0 entspricht der Phaseninformation im Bild mit der ursprünglich zugeordneten Anfangsvarianz V0 und V i / wi ist die Varianz der mit dem Kernel gefalteten Daten. Es ist nun notwendig die Größe v i / wi zu bestimmen. Diese Größe stellt die Varianz von WIi-1 dar und lässt sich leicht berechnen. Stellt man eine diskrete, lineare Transformation eines Vektors x als eine Matrix M dar, so kann man den Ergebnisvektor y über die Formel y = M·x berechnen. Wenn x einer Gauß'schen Fehlerstatistik (mit Durchschnitt = 0 und Kovarianzmatrix Cx) unterliegt, dann ist die Kovarianzmatrix des Ergebnisses Cy durch die Formel Cy = M·Cx·Mt gegeben. Hier steht die Funktion t für komplex Transponieren. Die Hauptdiagonale dieser Kovarianzmatrix enthält die Varianzen der Werte y. Ebenso lässt sich nun die Varianz von Ii-1 ausrechnen, da auch diese durch eine lineare Transformation (Gleichung (4)) gegeben ist.
-
In einem nächsten Schritt können nun die Phasenwerte in Abhängigkeit von der Varianz kombiniert werden, d. h. die Originalphasenwerte von Schritt 22 mit den abgeschätzten Phasenwerten von Schritt 24 (Schritt 25). Ist die Varianz eines Phasenwertes gering, so wird seine Gewichtung bei der Addition der Phasenwerte hoch sein, ist die Varianz groß, so wird die Gewichtung klein sein, da dies auf eine große Unsicherheit bei den bestimmten Phasenwerten schließen lässt. Durch die Anwendung des Filterkernels wird die in einem Bildpunkt enthaltene Phase auf die anderen benachbarten Bildpunkte übertragen, und es ergibt sich ein neuer weiterer Phasenbilddatensatz. Dieser neue Phasenbilddatensatz kann mit dem ursprünglichen Phasenbilddatensatz verglichen werden (Schritt 26). Ist der Unterschied zwischen dem neu erstellten Phasenbilddatensatz und dem Originalphasendatensatz größer als ein vorbestimmter Grenzwert, so bedeutet dies, dass die in Schritt 27 überprüfte Stoppbedingung noch nicht erfüllt ist und die Anwendung des Filterkernels auf die neuen Daten wird wiederholt, d. h. die Abschätzung der Phasenwerte und der Varianz durch die lineare Transformation. Im Schritt 26 werden dann wiederum die Phasenbilddatensätze der Iterationsschritte i und i – 1 verglichen und die lineare Transformation wird solange wiederholt, bis der Unterschied in den Phasenbilddatensätzen bei aufeinander folgenden Iterationen geringer als der vorbestimmte Grenzwert ist, was einer Stoppbedingung für die Iteration bildet. Ist die Stoppbedingung erfüllt, so bedeutet dies, dass der finale Phasenbilddatensatz in Schritt 28 vorliegt, der dann der Phaseninformation entspricht, die durch die MR Anlage und den Empfangszweig bedingt ist.
-
Wenn es nicht klar ist, welcher Filterkernel für die lineare Transformation in Schritt 24 verwendet werden sollen, so können auch mehrere Filterkernel wP oder WP verwendet werden und die Ergebnisse in Abhängigkeit von den Varianzen gewichtet werden. Beispielsweise kann der Filterkernel ein interpolierender oder ein extrapolierender Kernel sein. Für mehrere Filterkernel P kann obige Gleichung 4 wie folgt verallgemeinert werden.
-
-
Wie in Gleichung 4 ignoriert diese Formulierung die Tatsache, dass die Fehler in den Varianzen korreliert sein mögen. Hier kann es weiterhin vorteilhaft sein, spezielle oder auf Experimenten basierende Gewichtungen k
p zu berücksichtigen. Dies kann beispielsweise erfolgen, um mehr Gewicht auf interpolierende Filterkernel zu setzen, beispielsweise wenn Daten von einer geschlossenen Oberfläche oder einer geschlossenen Kontur um die interessierenden Bildpunkte herum verwendet werden, anstelle von extrapolierenden Filterkerneln. Weiterhin können die Gewichtungen verwendet werden, um den Anteil der durch die Kernel berechneten Daten im Vergleich zu den Originaldaten zu verringern. Sonst würden die mit dem Kernel gefalteten Daten die Originaldaten dominieren, hierbei ist es möglich,
wp = 1 / p zu setzen, woraus Gleichung 6 folgt.
-
Die Varianz bei einem Iterationsschritt i ist dann
-
-
Da jeder mit dem Filterkernel gefilterte Phasenbilddatensatz abschließend zu einem gleichen, nämlich dem finalen, Phasenbilddatensatz führen soll, kann eine paarweise Addition von Datensätzen verwendet werden, um die Berechnung auf Inkonsistenzen zu testen. Im Allgemeinen sollte die Differenz zwischen zwei berechneten Phasenbilddatensätzen geringer sein, als die Standardabweichung der Summe. x = (v1 + v2)–1/2(s1 – s2)
⇒ X = (V1 + V2)–1/2(S1 – S2) (8)
-
X ist somit die Distanz in Standardabweichungen zwischen den Datenpunkten. Ist dieser Wert groß, so ist das zugrundeliegende Modell falsch und die Berechnung des finalen Phasenbilddatensatzes kann beispielsweise abgebrochen werden oder eine Bedienperson kann informiert werden. Alternativ hierzu kann die Wahrscheinlichkeit, dass zwei Phasendatensätze eine bestimmte Distanz haben, wie folgt berechnet werden: P(s1 – s2|v1, v2) = (2π)–1Det(v1 + v2)–1Exp(–½(s1 – s2)*(v1 + v2)–1(s1 – s2))
⇒ P(I1 – I2|V1, V2) = (2π)–1Det(V1 + V2)–1Exp(–½(I1 – I2)*(V1 + V2)–1(I1 – I2)) (9)
-
Diese Wahrscheinlichkeit kann dazu verwendet werden, die Bildpunkte zu identifizieren, in denen Artefakte die Phaseninformation beherrschen oder Bildpunkte, in denen das vorgeschlagene Modell nicht funktioniert.
-
Zusammenfassend hat das vorbeschriebene Verfahren den Vorteil, dass mehr Bildpunkte bei der Abschätzung der MR systembedingten Phaseninformation verwendet werden können, wobei jeder Bildpunkt in Abhängigkeit von der Zusammensetzung und dem Signal-zu-Rausch-Verhältnis gewichtet wird. Weiterhin können die Varianzen über die verschiedenen Iterationen beobachtet werden und es können verschiedene Filterkernel kombiniert werden.