DE69937964T2 - Transportreagentien - Google Patents
Transportreagentien Download PDFInfo
- Publication number
- DE69937964T2 DE69937964T2 DE69937964T DE69937964T DE69937964T2 DE 69937964 T2 DE69937964 T2 DE 69937964T2 DE 69937964 T DE69937964 T DE 69937964T DE 69937964 T DE69937964 T DE 69937964T DE 69937964 T2 DE69937964 T2 DE 69937964T2
- Authority
- DE
- Germany
- Prior art keywords
- compound
- composition
- group
- cells
- cell
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Lifetime
Links
- 0 C*C(C*)CN(*N(*)CC(*)CNC)N Chemical compound C*C(C*)CN(*N(*)CC(*)CNC)N 0.000 description 1
- CBASPNBHVYBJAY-UHFFFAOYSA-N CCC(CNC(N)=O)O Chemical compound CCC(CNC(N)=O)O CBASPNBHVYBJAY-UHFFFAOYSA-N 0.000 description 1
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/14—Particulate form, e.g. powders, Processes for size reducing of pure drugs or the resulting products, Pure drug nanoparticles
- A61K9/16—Agglomerates; Granulates; Microbeadlets ; Microspheres; Pellets; Solid products obtained by spray drying, spray freeze drying, spray congealing,(multiple) emulsion solvent evaporation or extraction
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/13—Amines
- A61K31/14—Quaternary ammonium compounds, e.g. edrophonium, choline
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/22—Hormones
- A61K38/28—Insulins
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/40—Transferrins, e.g. lactoferrins, ovotransferrins
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/54—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an organic compound
- A61K47/543—Lipids, e.g. triglycerides; Polyamines, e.g. spermine or spermidine
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C211/00—Compounds containing amino groups bound to a carbon skeleton
- C07C211/01—Compounds containing amino groups bound to a carbon skeleton having amino groups bound to acyclic carbon atoms
- C07C211/20—Compounds containing amino groups bound to a carbon skeleton having amino groups bound to acyclic carbon atoms of an acyclic unsaturated carbon skeleton
- C07C211/21—Monoamines
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C211/00—Compounds containing amino groups bound to a carbon skeleton
- C07C211/62—Quaternary ammonium compounds
- C07C211/63—Quaternary ammonium compounds having quaternised nitrogen atoms bound to acyclic carbon atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C211/00—Compounds containing amino groups bound to a carbon skeleton
- C07C211/62—Quaternary ammonium compounds
- C07C211/64—Quaternary ammonium compounds having quaternised nitrogen atoms bound to carbon atoms of six-membered aromatic rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C229/00—Compounds containing amino and carboxyl groups bound to the same carbon skeleton
- C07C229/02—Compounds containing amino and carboxyl groups bound to the same carbon skeleton having amino and carboxyl groups bound to acyclic carbon atoms of the same carbon skeleton
- C07C229/04—Compounds containing amino and carboxyl groups bound to the same carbon skeleton having amino and carboxyl groups bound to acyclic carbon atoms of the same carbon skeleton the carbon skeleton being acyclic and saturated
- C07C229/26—Compounds containing amino and carboxyl groups bound to the same carbon skeleton having amino and carboxyl groups bound to acyclic carbon atoms of the same carbon skeleton the carbon skeleton being acyclic and saturated having more than one amino group bound to the carbon skeleton, e.g. lysine
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D209/00—Heterocyclic compounds containing five-membered rings, condensed with other rings, with one nitrogen atom as the only ring hetero atom
- C07D209/02—Heterocyclic compounds containing five-membered rings, condensed with other rings, with one nitrogen atom as the only ring hetero atom condensed with one carbocyclic ring
- C07D209/44—Iso-indoles; Hydrogenated iso-indoles
- C07D209/48—Iso-indoles; Hydrogenated iso-indoles with oxygen atoms in positions 1 and 3, e.g. phthalimide
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D241/00—Heterocyclic compounds containing 1,4-diazine or hydrogenated 1,4-diazine rings
- C07D241/02—Heterocyclic compounds containing 1,4-diazine or hydrogenated 1,4-diazine rings not condensed with other rings
- C07D241/10—Heterocyclic compounds containing 1,4-diazine or hydrogenated 1,4-diazine rings not condensed with other rings having three double bonds between ring members or between ring members and non-ring members
- C07D241/12—Heterocyclic compounds containing 1,4-diazine or hydrogenated 1,4-diazine rings not condensed with other rings having three double bonds between ring members or between ring members and non-ring members with only hydrogen atoms, hydrocarbon or substituted hydrocarbon radicals, directly attached to ring carbon atoms
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/87—Introduction of foreign genetic material using processes not otherwise provided for, e.g. co-transformation
- C12N15/88—Introduction of foreign genetic material using processes not otherwise provided for, e.g. co-transformation using microencapsulation, e.g. using amphiphile liposome vesicle
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y10—TECHNICAL SUBJECTS COVERED BY FORMER USPC
- Y10S—TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y10S435/00—Chemistry: molecular biology and microbiology
- Y10S435/81—Packaged device or kit
Description
- Hintergrund der Erfindung
- Gebiet der Erfindung
- Die vorliegende Erfindung bezieht sich auf kationische Lipide und Zusammensetzungen von kationischen Lipiden, die bei Lipid-Aggregaten für den Transport von Makromolekülen und weiteren Verbindungen in Zellen von Nutzen sind.
- Stand der Technik
- Lipid-Aggregate wie etwa Liposome haben sich als Transport-Agenzien, um Makromoleküle wie etwa DNA, RNA, Protein und kleine chemische Verbindungen wie etwa Pharmazeutika in Zellen einzubringen, als zweckmäßig erwiesen. Im Besonderen haben sich Lipid-Aggregate, die kationische Lipid-Komponenten umfassen, beim Transport von anionischen Molekülen zu Zellen als besonders wirksam erwiesen. Teilweise wird angenommen, dass die Wirksamkeit kationischer Lipide aus verstärkter Affinität für Zellen, von denen einige eine negative Nettoladung tragen, resultiert. Ebenfalls ermöglicht die positive Nettoladung auf Lipid-Aggregaten, die ein kationisches Lipid umfassen, dass das Aggregat an Polyanionen wie etwa Nukleinsäuren binden kann. Von Lipid-Aggregaten, die DNA enthalten, ist bekannt, dass es sich um wirksame Agenzien für effiziente Transfektion von Zielzellen handelt.
- Die Struktur zahlreicher Arten von Lipid-Aggregaten variiert in Abhängigkeit von Zusammensetzung und Verfahren für das Bilden des Aggregats. Solche Aggregate schließen Liposome, unilamellare Vesikel, multilamellare Vesikel, Mizellen und dergleichen ein, deren jeweilige Größen im Nanometer- bis Mikrometerbereich liegen. Verfahren für das Herstellen von Lipid-Aggregaten sind im Stand der Technik hinreichend bekannt. Der vordergründige Schwachpunkt bei dem Verwenden von herkömmlichen Phospholipid enthaltenden Liposomen für das Transportieren besteht darin, dass das abzugebende Material eingekapselt werden muss und dass die Liposom-Zusammensetzung eine negative Nettoladung aufweist, die von der negativ geladenen Zelloberfläche nicht angezogen wird. Durch das Kombinieren von kationischen Lipid-Verbindungen mit einem Phospholipid können positiv geladene Vesikel und weitere Arten von Lipid-Aggregaten DNA, die negativ geladen ist, binden, von Zielzellen aufgenommen werden und Zielzellen transfizieren. (Felgner, P. L. et al. (1987) Proc. Natl. Acad. Sci. USA 84: 7413–7417; Eppstein, D. et al.,
US Pat. Nr. 4,897,355 .). -
- DOTMA an sich oder in einer 1:1 Kombination mit Dioleoylphosphatidylethanolamin (DOPE) wird unter Verwendung von standardmäßigen Techniken in Liposome formuliert. Felgner, et al. oben demonstrierten, dass solche Liposome effizientes Transportieren von Nukleinsäuren zu manchen Arten von Zellen bereitstellten. Eine Formulierung von DOTMA:DOPE (1:1) wird unter dem Markennamen LIPOFECTIN (Life Technologies, Inc., Rockville, MD) verkauft. Bei einem weiteren, im Handel erhältlichen kationischen Lipid handelt es sich um 1,2-Bis(oleoyloxy)-3-3-(trimethylammonium)propan (DOTAP), das sich von DOTMA lediglich dahingehend unterscheidet, dass die Oleoyl-Gruppen mittels Ester- und nicht mittels Etherbindungen an das Propylamin gebunden sind. Eine damit in Zusammenhang stehende Gruppe von Verbindungen unterscheidet sich von DOTMA und DOTAP dahingehend, dass eine der Methylgruppen der Trimethylammoniumgruppe durch eine Hydroxyethylgruppe ersetzt wurde. Verbindungen dieser Art ähneln dem Rosenthal Inhibitor (RI) von Phospholipase A (Rosenthal, A. F. und Geyer, R. P. (1960) J. Biol. Chem. 235: 2202–2206), der an den Propylamin-Kern gebundene Stearoylester aufweist. Die Dioleoylanaloga von RI werden üblicherweise als DORI-Ether und DORI-Ester abgekürzt, in Abhängigkeit der Bindung der Fettsäuregruppen an den Propylamin-Kern. Die Hydroxygruppe kann als eine Stelle für weiteres Funktionalisieren verwendet werden.
-
- Eine weitere Klasse von Verbindungen wurde von Behr et al. (1989) Proc. Natl. Acad. Sci. USA 86: 6982–6986;
EPO Veröffentlichung 0 394 111 (24. Okt. 1990) offenbart, wobei Carboxyspermin an zwei Arten von Lipiden konjugiert wurde. Bei der Struktur von 5-Carboxyspermylglycindioctadecylamid (DOGS) handelt es sich um folgende: -
- Sowohl DOGS als auch DPPES wurden für das Beschichten von Plasmiden verwendet, wobei ein Komplex aus Lipid-Aggregat gebildet wurde, der effiziente Transfektion bereitstellt. Die Verbindungen gelten bei der Transfektion einiger Zelllinien als effizienter und weniger toxisch als DOTMA. DOGS ist im Handel als TRANSFECTAMTM (Promega, Madison, Wis.) erhältlich.
- Eine weitere Klasse von Verbindungen wurde ebenfalls beschrieben, bei denen Carboxyspermin mittels einer Amidbindung an Lipide konjugiert war (Gebeyehu, G. et al.,
US Patent Nr. 5,334,761 ). Diese Verbindungen sind für ein effizientes Transportieren von Nukleinsäuren in zahlreiche Zellen zweckmäßig und es handelt sich bei denselben ebenfalls um Zwischenprodukte für das Herstellen weiterer solcher Lipide. 2,3-Di-oleyloxy-N-[2(spermin-carboxamido)ethyl]-N,N-dimethyl-1-propan-aminium (DOSPA) ist als eine 3:1 (w/w) Formulierung mit DOPE unter dem Markennamen LipofectAMINE (erhältlich von Life Technologies, Inc., Rockville, MD) erhältlich. Bei der Struktur von DOSPA handelt es sich um folgende: - Lipid-Verbindungen mit einer Spermin-Kopfgruppe wurden ebenfalls beschrieben (Haces, A., et al.,
US Patent Nr. 5,674,908 ). Diese Verbindungen sind speziell für das Transportieren von Nukleinsäuren in Insektenzellen zweckmäßig. Eine 1:15 (M/M) Formulierung von Tetramethyltetrapalmitylspermin (TM-TPS) mit DOPE ist im Handel unter dem Markennamen CellFECTIN (Life-Technologies, Inc., Rockville, MD) erhältlich. Die Struktur von TM-TPS wird untenstehend gezeigt: -
- Von mit DC-Chol formulierten Liposomen wird angenommen, dass sie für einige Zelllinien effizientere Transfektion und geringere Toxizität als DOTMA-enthaltende Liposome bereitstellen.
- Von Lipopolylysin, das durch das Konjugieren von Polylysin an DOPE gebildet wird, wurde berichtet, dass es beim Transfizieren in Gegenwart von Serum besonders wirksam ist, wobei es sich hier um eine Bedingung handelt, die wahrscheinlich in vivo vorgefunden wird (Zhou, X. et al. (1991) Biochim. Biophys. Acta 1065: 8–14).
-
WO 97/42819 -
US 5,744,335 beschreibt ein Verfahren für das Transfizieren einer Zelle mit einem Polynukleotid, das mit einer oder mehr als einer amphiphatischen Verbindung und einem DNA-bindenden Protein wie etwa H1, H2A oder H2B vermischt ist. Die beschriebenen amphiphatischen Verbindungen schließen kationische amphiphatische Verbindungen ein, die eine nicht natürliche Polyamingruppe und eine hydrophobe Gruppe umfassen. - McCluskie et al, Antisense & Nucleic Acid Drug Development (1998), 8(5), Seiten 401–414, beschreibt den direkten Transfer von DNA in das Atemsystem von Mäusen unter Verwendung nackter und Lipid-formulierter DNA. Die beschriebenen Lipide schließen Tetramethyltetraalkylspermin-Analoga und DMRIE/Cholesterin-Formulierungen ein.
-
EP 0846680 beschreibt weitere kationische Lipide für das Transportieren von Nukleinsäuren in Zellen, im Besonderen Guanidino-Lipide. -
US 5,830,430 beschreibt kationische Lipide für das Transportieren von bioaktiven Materialien wie etwa Nukleinsäuren und Pharmazeutika in Zellen, im Besonderen Lipide, die zumindest zwei kationische Gruppen umfassen. -
WO 98/40502 -
WO 98/40499 -
WO 98/02190 -
FR 1567214 - Trotz Fortschritten auf dem Gebiet besteht weiterhin ein Bedarf an einer Vielzahl von verbesserten kationischen Lipid-Verbindungen. Im Besonderen wurde bisher kein einzelnes kationisches Lipid gefunden, dass bei allen Zellarten funktioniert. Angesichts dessen, dass sich unterschiedliche Zellarten hinsichtlich Membranzusammensetzung unterscheiden, ist es nicht erstaunlich, dass unterschiedliche Zusammensetzungen und Arten von Lipid-Aggregaten bei unterschiedlichen Zellarten wirksam sind, entweder aufgrund ihrer Fähigkeit zu Kontakt und Fusion mit Zielzellmembranen oder aufgrund von Aspekten des Transferprozesses an sich. Derzeit werden diese Prozesse nicht gut verstanden, infolgedessen ist das Design von wirksamen liposomalen Vorläufern weitgehend empirisch. Neben Inhalt und Transfer sind weitere Faktoren von Bedeutung, zum Beispiel die Fähigkeit, für den vorgesehenen Zweck geeignete Lipid-Aggregate zu bilden, die Möglichkeit, Zellen in Gegenwart von Serum zu transfizieren, Toxizität gegenüber den Zielzellen, Stabilität als ein Träger für die abzugebende Verbindung und die Fähigkeit, in einer in vivo Umgebung zu funktionieren. Zusätzlich können Lipid-Aggregate durch Ausweiten der Palette an Substanzen, die zu Zellen transportiert werden können, verbessert werden. Die kationischen Lipid-Verbindungen der vorliegenden Erfindung weisen verbesserte Funktion hinsichtlich mehrerer der vorangehenden Attribute auf.
- Zusammenfassung der Erfindung
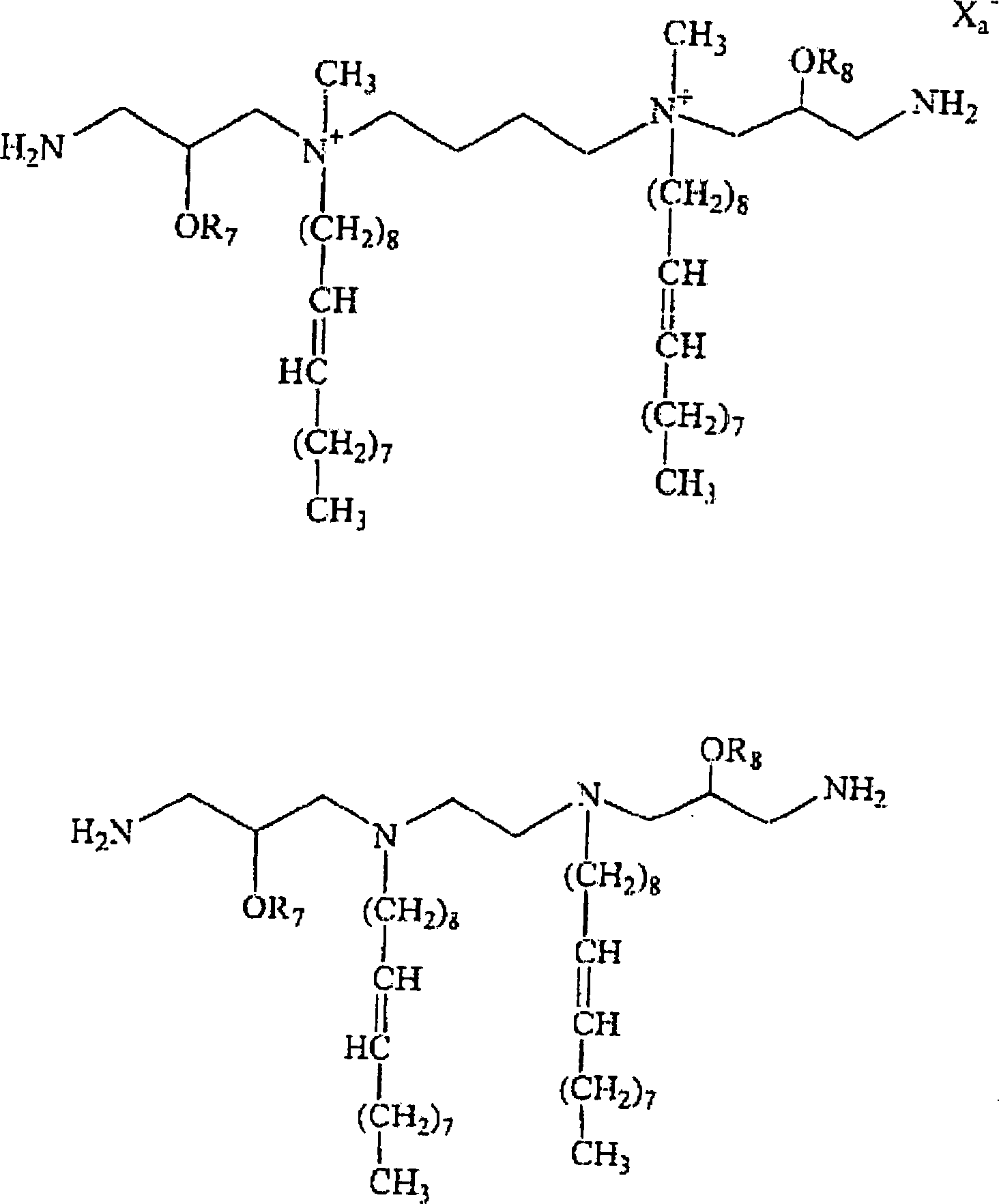
- Eine Verbindung mit der folgenden Formel: worin
es sich bei Q um N handelt;
es sich bei L um ein bivalentes, organisches Radikal handelt, das in der Lage ist, jedes Q zu binden;
R1, R3, R4 und R6 unabhängig voneinander ausgewählt werden aus der Gruppe bestehend aus H und C8-C24 Alkenyl, C8-C24 Aryl und C8-C24 Alkyl, optional substituiert mit einem oder mehr als einem Element ausgewählt aus einem Alkohol, einem Amin, einem Amid, einem Ether, einem Polyether, einem Polyamid, einem Ester, einem Mercaptan, einem Harnstoff, einem Thioharnstoff, einem Guanidyl oder einer Carbamoylgruppe;
und worin es sich bei zumindest einem Element aus R1, R3, R4 und R6 um eine geradkettige oder verzweigte Alkyl- oder Alkenylgruppe oder eine Arylgruppe handelt;
es sich bei X– um ein physiologisch verträgliches Anion handelt;
es sich bei a um eine Zahl positiver Ladung, dividiert durch die Valenz von X, handelt;
es sich bei r, s, u und y um 0 oder 1 handelt, vorausgesetzt, die Valenzanforderungen von Stickstoff sind erfüllt; und
es sich bei R7 und R8 um H handelt. - Die Verbindungen der Erfindung sind, entweder allein oder in Kombination mit weiteren Lipid-Aggregat bildenden Komponenten (z. B. DOPE, DOPC oder Cholesterin) für das Formulieren in Liposome oder weitere Lipid-Aggregate zweckmäßig. Solche Aggregate sind polykationisch und in der Lage, mit anionischen Makromolekülen wie etwa Nukleinsäuren stabile Komplexe zu bilden. Der Komplex aus Lipid-Aggregat und Makromolekül interagiert mit Zellen, wodurch das polyanionische Makromolekül für Absorption und Aufnahme durch die Zelle zugänglich wird.
- Die vorliegende Erfindung stellt ein Lipid-Aggregat bereit, das eine oder mehr als eine Verbindung der vorliegenden Erfindung umfasst. Bevorzugt umfasst das Lipid-Aggregat zumindest eine Lipid-Aggregat bildende Verbindung. Bevorzugt wird die Lipid-Aggregat bildende Verbindung ausgewählt aus der Gruppe bestehend aus DOPE, DOPC und Cholesterin.
- Die Verbindungen der vorliegenden Erfindung können ebenfalls konjugiert sein an oder gemischt sein mit oder verwendet werden in Verbindung mit einer Vielzahl von zweckmäßigen Molekülen und Substanzen wie etwa Proteinen, Peptiden, Wachstumsfaktoren und dergleichen, um Zell-Targeting, Aufnahme, Internalisierung, Kern-Targeting und Expression zu verstärken.
- Diese Erfindung schließt ebenfalls Lipid-Aggregate, die eine oder mehr als eine Verbindung der vorliegenden Erfindung oder Mischungen davon umfassen, ein. Solche Lipid-Aggregate können mit einer oder mehr als einer Aggregat-bildenden Komponente und/oder Transfektionsverstärkern kombiniert werden.
- Die hierin offenbarten Verfahren für das Transfizieren, welche die Verbindungen oder Zusammensetzungen (wie etwa die oben beschriebenen) der vorliegenden Erfindung und Mischungen davon einsetzen, können bei in vitro Transfektion von Zellen verwendet werden, im Besonderen bei Transfektion eukaryotischer Zellen oder Geweben einschließlich Tierzellen, Menschenzellen, Insektenzellen, Pflanzenzellen, Vogelzellen, Fischzellen, Säugetierzellen und dergleichen.
- Dementsprechend stellt die vorliegende Erfindung ein Verfahren für das Einbringen eines Polyanions in eine Zelle oder Zellen bereit, wobei das Verfahren das Bilden eines Liposoms aus einer positiv geladenen Verbindung gemäß der Erfindung, das Kontaktieren des Liposoms mit Polyanion für das Bilden eines positiv geladenen Komplexes aus Polyanion und Liposom und Inkubieren des Komplexes mit einer Zelle oder Zellen umfasst.
- Die hierin offenbarten Verfahren können für das Erzeugen von transfizierten Zellen oder Geweben, die zweckmäßige Genprodukte exprimieren, verwendet werden. Die hierin offenbarten Verfahren können ebenfalls als ein Schritt bei der Züchtung von transgenen Tieren verwendet werden. Die hierin offenbarten Verfahren sind bei jedem beliebigen therapeutischen Verfahren zweckmäßig, welche das Einbringen von Nukleinsäuren in Zellen oder Gewebe erfordern. Im Besonderen sind diese Verfahren bei der Behandlung von Krebs, bei ex vivo Gentherapie und bei diagnostischen Verfahren zweckmäßig. Siehe zum Beispiel
US Patent Nr. 5,589,466 von Felgner, et al. - Die Transfektionsverbindungen oder -zusammensetzungen dieser Erfindung können als Forschungsreagenzien bei jeder beliebigen Transfektion von Zellen oder Geweben, die zu Forschungszwecken erfolgt, eingesetzt werden. Nukleinsäuren, welche durch die Verfahren dieser Erfindung transfiziert werden können, schließen DNA und RNA aus jeder beliebigen Quelle, einschließlich natürlicher Basen oder nicht-natürlicher Basen, ein und schließen jene, die codieren, und in der Lage sind, therapeutische oder anderswie zweckmäßige Proteine in Zellen oder Geweben zu exprimieren, jene, die Expression von Nukleinsäuren in Zellen oder Geweben hemmen, jene, die enzymatische Aktivität hemmen oder Enzyme aktivieren, jene, die Reaktionen katalysieren (Ribozyme) und jene, die in diagnostischen Assays funktionieren, ein.
- Die hierin bereitgestellten Verbindungen, Zusammensetzungen und Verfahren können ebenfalls ohne weiteres mit Blick auf die Offenbarung hierin für das Einbringen von biologisch aktiven Makromolekülen oder Substanzen, bei denen es sich um andere als um Nukleinsäuren, einschließlich, unter anderem, Polyaminen, Polyaminsäuren, Polypeptiden, Proteinen, Biotin und Polysacchariden, handelt, in Zellen angepasst werden. Weitere zweckmäßige Materialien, zum Beispiel therapeutischen Agenzien, diagnostische Materialien und Forschungsreagenzien, können durch die Verfahren dieser Offenbarung in Zellen eingebracht werden. Gemäß einem bevorzugten Aspekt kann durch die vorliegende Erfindung jeder beliebige Nukleinsäurevektor zu einer oder in eine Zelle transportiert werden.
- Dementsprechend wird ein Verfahren für das Einbringen einer biologisch aktiven Substanz in eine Zelle offenbart, wobei das Verfahren das Bilden eines Liposoms aus einer Verbindung gemäß der Erfindung und einer biologisch aktiven Substanz und Inkubieren des Liposoms mit einer Zelle oder Zellkultur umfasst.
- Die Erfindung bezieht sich ebenfalls auf Zusammensetzungen, die eine oder mehr als eine Verbindung der Erfindung umfassen.
- Die Erfindung bezieht sich ebenfalls auf Zusammensetzungen, die eine oder mehr als eine Verbindung der Erfindung und eine oder mehr als eine zusätzliche Komponente ausgewählt aus der Gruppe bestehend aus Nukleinsäuren, einer Zelle, einer Zellkultur, Zellen, Puffern, Kulturmedien, biologisch aktiver Substanz, neutralen Lipiden und Transfektionsverstärkern, bevorzugt eine Nukleinsäure, umfassen.
- Diese Erfindung schließt ebenfalls Transfektions-Kits ein, welche eine oder mehr als eine Verbindung oder Zusammensetzung der vorliegenden Erfindung oder Mischungen davon einschließen. Im Besonderen stellt die Erfindung ein Kit, das eine oder mehr als eine Verbindung der vorliegenden Erfindung und zumindest eine zusätzliche Komponente ausgewählt aus der Gruppe bestehend aus einer Zelle, Zellen, einem Zellkulturmedium, einer Nukleinsäure, einem Transfektionsverstärker und Instruktionen für das Transfizieren einer Zelle oder von Zellen umfasst.
- Die Offenbarung bezieht sich ebenfalls auf Zwischenprodukte und Verfahren für das Verwenden solcher Zwischenprodukte für das Herstellen der Verbindungen oder Zusammensetzungen der Erfindung. Die Offenbarung bezieht sich ebenfalls auf die Zusammensetzungen, Verbindungen oder Komponenten, die durch die Interaktion von bei den Synthese-Verfahren der Erfindung verwendeten Materialien (Zwischenprodukte, Verbindungen, Lipide, etc.) erhalten werden.
- Weitere bevorzugte Ausführungsformen der vorliegenden Erfindung werden dem Durchschnittsfachmann unter Bezugnahme auf die nachfolgenden Zeichnungen und die Beschreibung der Erfindung ersichtlich.
- Kurze Beschreibung der Zeichnungen
-
1 ist ein Graph, der die Transfektion von HEK-293 Zellen mit kationischen Transfektionsreagenzien zeigt. -
2 ist ein Graph, der die Transfektion von COS-7 Zellen mit kationischen Transfektionsreagenzien zeigt. -
3 ist ein Graph, der die Transfektion von CHO-K1 Zellen mit kationischen Transfektionsreagenzien zeigt. -
4 ist ein Graph, der die Transfektion von HeLa-Zellen mit kationischen Transfektionsreagenzien zeigt. - Detaillierte Beschreibung der bevorzugten Ausführungsformen
- Die vorliegende Erfindung bezieht sich auf kationische Lipide und Zusammensetzungen von kationischen Lipiden, die bei Lipid-Aggregaten für das Transportieren von Makromolekülen und weiteren Verbindungen in Zellen von Nutzen sind. Die Verbindungen können allein oder in Kombination mit weiteren Verbindungen verwendet werden, um Liposome und weitere Lipid-Aggregate, die für das Transfizieren oder Transportieren von Verbindungen zu Zielzellen geeignet sind, in vitro herzustellen.
- Die Verbindungen der vorliegenden Erfindung sind bevorzugt polykationisch und bilden somit bevorzugt hochstabile Komplexe mit zahlreichen anionischen Makromolekülen, im Besonderen Polyanionen wie etwa Nukleinsäuren. Diese Verbindungen weisen die Eigenschaft auf, wenn sie in Wasser dispergiert sind, Lipid-Aggregate zu bilden, die sich stark, über ihren kationischen Anteil, mit Polyanionen assoziieren. Durch Verwenden eines Überschusses kationischer Ladungen bezüglich der anionischen Verbindung können die Komplexe Polyanion-Lipid auf Zellmembranen absorbiert werden, wodurch die Aufnahme der erwünschten Verbindung durch die Zellen ermöglicht wird.
- Die Offenbarung bezieht sich ebenfalls auf Zwischenprodukte für das Herstellen der Verbindungen und Zusammensetzungen der Erfindung.
- Spezifischer gesehen bezieht sich die vorliegende Erfindung auf ein kationisches Lipid für das Transfizieren, das eine größere Transfektionswirksamkeit bei den drei häufigsten Zellarten, die in Expressionsforschung (CHO-K1, COS-7 und HEK293) verwendet werden, aufweist als im Handel erhältliche Produkte, was es für Anwendungen mit höheren Durchsätzen zweckmäßig macht; und das ein einfach zu verwendendes Protokoll aufweist, wie durch die Tatsache definiert, dass keine zusätzlichen Reagenzien (z. B. etwa LipofectAMINE PLUS Reagens erhältlich von Life Technologies, Inc., Rockville, MD), kein Entfernen von Serum und daher keine Änderungen hinsichtlich Medium erforderlich sind und der Komplex DNA/Lipid vor dem Assay nicht von den Zellen entfernt werden muss.
- Gemäß einem Aspekt bezieht sich die vorliegende Erfindung auf Verbindungen, welche die folgende Formel aufweisen: worin
es sich bei Q um N handelt;
es sich bei L um ein bivalentes, organisches Radikal handelt, das in der Lage ist, jedes Q zu binden;
R1, R3, R4 und R6 unabhängig voneinander ausgewählt werden aus der Gruppe bestehend aus H und C8-C24 Alkenyl, C8-C24 Aryl oder C8-C24 Alkyl, optional substituiert mit einem oder mehr als einem Element ausgewählt aus einem Alkohol, einem Amin, einem Amid, einem Ether, einem Polyether, einem Polyamid, einem Ester, einem Mercaptan, einem Harnstoff, einem Thioharnstoff, einem Guanidyl oder einer Carbamoylgruppe;
und worin es sich bei zumindest einem Element aus R1, R3, R4 und R6 um eine geradkettige oder verzweigte Alkyl- oder Alkenylgruppe oder eine Arylgruppe handelt;
es sich bei r, s, u und y um 0 oder 1 handelt, vorausgesetzt, die Valenzanforderungen von Stickstoff sind erfüllt und die Verbindung ist polykationisch;
es sich bei R7 und R8 um H handelt,
es sich bei X– um ein physiologisch verträgliches Anion handelt; und
es sich bei a um die Zahl von positiver Ladung dividiert durch die Valenz von X handelt. -
-
- Spezifische Verbindungen innerhalb des Schutzumfangs der Erfindung schließen die nachfolgenden Beispiele ein. Bei R7 und R8 handelt es in der Formel um H.
- Manche der Verbindungen der Erfindung können in physiologischen Medien nicht ausreichend löslich sein, um für Verfahren für das Transportieren und Transfizieren eingesetzt zu werden. Der Durchschnittsfachmann wird schätzen, dass es eine Vielzahl von im Stand der Technik erhältlichen Techniken gibt, um die Löslichkeit solcher Verbindungen in wässrigen Medien zu verstärken. Solche Verfahren können ohne weiteres und ohne unangemessene Versuche bei den hierin beschriebenen Verbindungen verwendet werden.
- Definitionen
- Bei zweckmäßigen Arylgruppen handelt es sich um C6-24 Aryl. Typische Arylgruppen schließen Phenyl, Naphthyl, Phenanthryl, Anthracyl, Indenyl, Azulenyl, Biphenyl, Biphenylenyl, Fluorenyl, Pyrenyl, Aceanthrenyl, Cholanthrenyl und Acephenanthrenyl ein.
- Bei zweckmäßigen Alkylgruppen handelt es sich um geradkettiges oder verzweigtes C8-24 Alkyl. Typische Alkylgruppen schließen Ethyl, Propyl, Isopropyl, Butyl, sec.-Butyl, tert.-Butyl, Pentyl, Hexyl, Octyl, Decyl, Dodecyl, Tetradecyl, Hexadecyl, Octadecyl, Eicosyl und Docosyl ein.
- Bei zweckmäßigen Alkenylgruppen handelt es sich um geradkettiges oder verzweigtes C8-24 Alkenyl. Typische Alkenylgruppen schließen Ethenyl, Propenyl, Isopropenyl, Butenyl, sec.-Butenyl, Hexenyl, Octenyl, Decenyl, Dodecenyl, im Speziellen 9-Dodecenyl, Tetradecenyl, im Speziellen 9-Tetradecenyl, Hexadecenyl, im Speziellen 9-Hexadecenyl, Octadecenyl, im Speziellen 9-Octadecenyl, Eicosenyl und Docosenyl ein.
- Bei zweckmäßigen Alkynylgruppen handelt es sich um geradkettiges oder verzweigtes C8-24 Alkynyl. Typische Alkynylgruppen schließen Ethynyl, Propynyl, Butynyl, Hexynyl, Octynyl, Decynyl, Dodecynyl, Tetradecynyl, Hexadecynyl, Octadecynyl, Eicosynyl und Docosynyl ein.
- Typische Alkylethergruppen schließen jede beliebige der oben genannten C2-100 Alkylgruppen mit einer Ethergruppe ein.
- Bei einer Ethergruppe handelt es sich um -O-.
- Typische Polyethergruppen schließen die Gruppe (CHR14-CH2-O)t- ein, worin es sich bei R14 um H oder eine C1-4 Alkylgruppe handelt und es sich bei t um eine ganze Zahl wie oben definiert handelt, bevorzugt handelt es sich bei t um 2 bis 5.
- Für die Zwecke der Erfindung handelt es sich bei einer Amidgruppe um ein organisches Radikal, das -NHC(O)- als eine funktionale Gruppe aufweist. Typische Amidgruppen schließen Alkylamide, Alkenylamide, Alkynylamide und Arylamide ein, wobei Alkyl, Alkenyl, Alkynyl und Aryl wie oben definiert sind.
- Typischerweise schließen Polyamidgruppen organische Radikale ein, die zwei oder mehr als zwei Amidgruppen wie oben definiert aufweisen.
- Typischerweise handelt es sich bei einer Estergruppe um ein organisches Radikal, das -C(O)-O- als eine funktionale Gruppe aufweist. Typische Estergruppen schließen R14-C(O)-O-R15 ein, worin es sich bei R14 und R15 um Alkylen-, Alkenylen-, Alkynylen- und Arylengruppen wie oben definiert handelt.
- Typischerweise handelt es sich bei Harnstoffgruppen um organische Radikale, die -NH-C(O)-NH- als eine funktionale Gruppe aufweisen. Typische Harnstoffgruppen schließen R14NH-C(O)-NHR14, R14NH-C(O)-NHR15, R14R15N-C(O)-NR14R15 ein, worin es sich bei R14 und R15 um Alkylen-, Alkenylen-, Alkynylen- und Arylengruppen wie oben definiert handelt.
- Typischerweise handelt es sich bei Thioharnstoffgruppen um organische Radikale, die eine Harnstoffgruppe wie oben definiert aufweisen, wobei der Sauerstoff in der Harnstoffgruppe durch Schwefel substituiert wird.
- Typischerweise handelt es sich bei Guanidylgruppen um organische Radikale, die -NH-C(NH)-NH- als eine funktionale Gruppe aufweisen. Typische Guanidylgruppen schließen R14NH-C(NH)-NHR14, R14H-C(NH)-NHR15 und R14R15N-C-(NH)-NR14R15 ein, worin es sich bei R14 und R15 um Alkylen-, Alkenylen-, Alkynylen- und Arylengruppen wie oben definiert handelt.
- Bei einer Carbamoylgruppe handelt es sich um -NH-C(O)-O-.
- Typische Carbonatgruppen schließen organische Radikale ein, die ein CO3 2– Radikal, d. h. -O-C(O)O, enthalten.
- Bei einer Phosphatgruppe handelt es sich um ein PO4 3– Radikal.
- Bei einer Sulfatgruppe handelt es sich um SO4 2– Radikal.
- Bei einer Sulfoxidgruppe handelt es sich um -S(O)-.
- Bei einer Imingruppe handelt es sich um -C-(N)-.
- Bei einer Carbonylgruppe handelt es sich um -C(O)-.
- Bei einer sekundären Aminogruppe handelt es sich um -NH-.
- Typischerweise handelt es sich bei Aminoalkoholgruppen um organische Radikale, die sowohl eine wie oben definierte sekundäre Aminogruppe als auch eine Hydroxygruppe aufweisen. Typische Aminoalkohole schließen Aminoethanol, Aminopropanol und Aminobutanol ein.
- Die Definition „bei D handelt es sich um eine Bindung" bedeutet, dass, wenn es sich bei D nicht um Q handelt, eine Einfachbindung zwischen (CH2)p und Z vorliegt.
- Biologische aktive Substanz bezieht sich auf jedes beliebige Molekül oder jede beliebige Mischung oder jeden beliebigen Komplex aus Molekülen, das/die/der eine biologische Wirkung in vitro und/oder in vivo ausübt, einschließlich Pharmazeutika, Medikamente, Proteine, Peptide, Polypeptide, Hormone, Vitamine, Steroide, Polyanionen, Nukleoside, Nukleotide, Nukleinsäuren (z. B. DNA oder RNA), Polynukleotide, etc.
- Kationische Lipide bezieht sich auf jedes beliebige kationische Lipid, das für Transfektion verwendet werden kann, einschließlich, aber nicht darauf beschränkt, DOSPA, DOTMA, DMRIE, DOTAP, DOGS und TM-TPS.
- Zelle bezieht sich auf eukaryotische Zellen jeder beliebigen Art und aus jeder beliebigen Quelle. Arten von eukaryotischen Zellen schließen epitheliale, fibroblastische, neuronale, hämatopoietische Zellen und dergleichen aus primären Zellen, Tumorzellen oder immortalisierten Zelllinien ein. Quellen von solchen Zellen schließen jedes beliebige Lebewesen wie etwa Mensch, Hund, Maus, Hamster, Katze, Rind, Schwein, Affe, Menschenaffe, Schaf, Fisch, Insekt, Pilz und jede beliebige Pflanze einschließlich Getreidepflanzen, Zierpflanzen und Bäume ein.
- Transportieren wird verwendet, um einen Prozess zu bezeichnen, durch welchen eine erwünschte Verbindung an eine Zielzelle übertragen wird, sodass die erwünschte Verbindung schlussendlich innerhalb der Zielzelle oder in oder auf der Membran der Zielzelle vorliegt. Bei einigen Verwendungen der Verbindungen der Erfindung wird die erwünschte Verbindung nicht ohne weiteres durch die Zielzelle aufgenommen und das Transportieren über Lipid-Aggregate ist ein Mittel, um die erwünschte Verbindung in die Zelle zu bringen. Bei gewissen Verwendungen wird das Transportieren zu einer spezifischen Art von Zielzellen bevorzugt und kann durch Verbindungen der Erfindung ermöglicht werden.
- Medikamente bezieht sich auf jedes beliebige therapeutische oder prophylaktische Agens, bei dem es sich nicht um Nahrungsmittel handelt, das bei Vorbeugung, Diagnose, Linderung, Behandlung oder Heilung von Krankheit bei Mensch oder Tier verwendet wird.
- Kit bezieht sich auf Transfektions- oder Proteinexpressions-Kits, die eine oder mehr als eine Verbindung der vorliegenden Erfindung oder Mischungen davon einschließen. Solche Kits können ein Trägermittel umfassen, das zwecks Aufnahme von einem oder mehr als einem Behältnis wie etwa Phiolen, Teströhrchen und dergleichen in engem Einschluss kompartimentiert ist. Jedes dieser Behältnisse umfasst Komponenten oder eine Mischung von Komponenten, die für das Durchführen von Transfektion benötigt werden. Solche Kits können eine oder mehr als eine Komponente ausgewählt aus Nukleinsäuren (bevorzugt ein oder mehr als ein Vektor), Zellen, eine oder mehr als eine Verbindung der vorliegenden Erfindung, Lipid-Aggregat bildende Verbindungen, Transfektionsverstärker, biologisch aktive Substanzen, etc. einschließen.
- Lipid-Aggregat ist ein gattungsgemäßer Begriff, der Liposome aller Arten, sowohl unilamellar als auch multilamellar sowie Mizellen und stärker amorphe Aggregate kationischer Lipide oder mit amphiphatischen Lipiden vermischte Lipide wie etwa Phospholipide und Steroide, einschließt.
- Lipid-Aggregat bildende Verbindungen bezieht sich auf neutrale Verbindungen oder Lipide wie etwa DOPE, DOPC und Cholesterin, etc.
- Zielzelle bezieht sich auf jede beliebige Zelle, zu der eine erwünschte Verbindung transportiert wird, wobei ein Lipid-Aggregat als Träger für die erwünsche Verbindung verwendet wird.
- Transfektion wird hierin verwendet, um das Transportieren von Nukleinsäure, Protein oder eines weiteren Makromoleküls zu einer Zielzelle zu bedeuten, sodass die Nukleinsäure, das Protein oder das weitere Makromolekül exprimiert wird oder eine biologische Funktion in der Zelle aufweist. Der Begriff „exprimierbare Nukleinsäure" schließt sowohl DNA als auch RNA unabhängig vom molekularen Gewicht ein und der Begriff „Expression" bedeutet jede beliebige Manifestation der funktionalen Gegenwart der Nukleinsäure innerhalb der Zelle, einschließlich, ohne Einschränkung, sowohl transienter Expression als auch stabiler Expression. Funktionale Aspekte schließen das Hemmen von Expression durch Transportieren von Oligonukleotiden oder Protein ein.
- Transfektionsverstärker bezieht sich im Allgemeinen auf Moleküle und Substanzen wie etwa Proteine, Peptide, Wachstumsfaktoren und dergleichen, die Zell-Targeting, Aufnahme, Internalisierung, Kern-Targeting und Expression verstärken. Solche Moleküle und Substanzen schließen Liganden wie etwa Insulin, Transferrin, Fibronektin, die auf die Zelloberfläche abzielen; Peptide, die auf zelluläre Integrinrezeptoren abzielen; und weitere Verbindungen wie etwa Plus Reagent (von Life Technologies, Inc., Rockville, Maryland erhältlich) ein. Beispiele von Transfektionsverstärkern finden sich im
US Patent Nr. 5,736,392 und der US Anmeldung mit der Nummer 09/039,780 die am 16. März 1998 eingereicht wurde. - Die Erfindung wird ferner durch die nachfolgenden Beispiele verdeutlicht, die sich bezüglich der Erfindung als ausschließlich exemplarisch verstehen. Die polykationischen Lipide wurden durch Befolgen der allgemeinen unten beschriebenen Reaktionsschemen hergestellt.
- Beispiel 1
- Synthese von N1,N4-Dioleoyl-diaminobutan (I)
- Eine Lösung aus 1,4-Diaminobutan (4,28 g, 48,6 mmol) und Triethylamin (20,4 ml, 146 mmol) in 10 ml trockenem Methylenchlorid wurde langsam zu einer Lösung aus Oleoylchlorid (30,0 g, 99,7 mmol) in 300 ml anhydrischem Methylenchlorid in einem Eisbad bei 0°C hinzugefügt. Die Reaktionsmischung wurde stark mit einem mechanischen Rührer gerührt. Nach vollständigem Hinzufügen wurde das Eisbad entfernt und die Mischung wurde bei Raumtemperatur 2,5 Tage lang gerührt. Die TLC-Analyse bestätigte, dass die Reaktion vollständig war und das Produkt ausgefällt worden war. Das überschüssige Oleoylchlorid wurde durch Filtrieren entfernt. Der Niederschlag wurde zwei Mal mit 50 ml Methylenchlorid gewaschen. Die Mutterlauge wurde konzentriert und mehr Produkt wurde ausgefällt. Dieser Niederschlag wurde filtriert und mit dem vorherigen Niederschlag vereinigt. Der resultierende Feststoff wurde 4 Stunden lang vakuumgetrocknet. Insgesamt wurden 27,0 g eines weißen Feststoffs des erwünschten Produkts, N1,N4-Dioleoyl-diaminobutan, erhalten.
- Synthese von N1,N4-Dioleyl-diaminobutan (II)
- Lithiumaluminiumhydrid (8,62 g, 95%, 216 mmol) wurde vorsichtig zu einer Suspension von N1,N4-Dioleyl-diaminobutan (27,0 g, 43,8 mmol) in 400 ml anhydrischem Diethylether bei 0°C hinzugefügt. Nach dem Hinzufügen wurde das Eisbad entfernt. Die Reaktionsmischung wurde langsam auf Raumtemperatur erwärmt und dann unter Rückfluss mit einer passenden Kondensationsvorrichtung vorsichtig erhitzt und 16 Stunden lang gerührt. Die Reaktionsmischung wurde dann gekühlt und sorgfältig bei 0°C mit 70 ml einer 1 N Natriumhydroxidlösung gelöscht. Weitere 500 ml Diethylether wurden hinzugefügt und die Mischung wurde weitere 2 Stunden lang bei Raumtemperatur gerührt. Die obere Etherschicht wurde schrittweise klar und dann getrennt. Die wässrige Schicht wurde drei Mal jeweils mit 100 ml Diethylether extrahiert. Die vereinigte Etherlösung wurde konzentriert und über Nacht im Hochvakuum getrocknet. Insgesamt wurden 17,0 g von öligem, farblosem N1,N4-Dioleyl-diaminobutan erhalten.
- Synthese von N1,N4-Dioleyl-N1,N4-di-[2-hydroxy-3-(N-phthalamido)propyl]-diamino-butan (III)
- Diisopropylethylamin (11,1 ml, 63,7 mmol) wurde zu einer Suspension aus N1,N4-Dioleyl-diaminobutan (15,5 g, 26,3 mmol) und N-(2,3-Epoxypropyl)-phthalimid (15,6 g, 76,8 mmol) in 110 ml trockenem N,N-Dimethylformamid hinzugefügt. Nach dem Spülen mit Stickstoff wurde die Reaktionsmischung in einem Rundkolben versiegelt und 24 Stunden lang auf ungefähr 90°C erhitzt. N,N-Dimethylformamid und Diisopropylethylamin wurden entfernt und ein gelbes Öl wurde erhalten. Dieses Rohmaterial wurde aus Ethanol rekistrallisiert. Insgesamt wurden 18,6 g eines weißen Feststoffs, N1,N4-Dioleyl-N1,N4-di-[2-hydroxy-3-(N-phthalamido)propyl]-diamino-butan, erhalten.
- Synthese von N1,N4-Dioleyl-N1,N4-di-[2-hydroxy-3-(N-aminopropyl)]-diaminobutan (IV) (nachstehend als DHDOS bezeichnet)
- Hydrazin (4,0 ml, 80% wässrig, 103 mmol) wurde zu einer Suspension aus N1,N4-Dioleyl-N1,N4-di-[2-hydroxy-3-(N-phthalamido)propyl]-diaminobutan (17,0 g, 17,1 mmol) in 250 ml trockenem Ethanol bei Raumtemperatur hinzugefügt. Mit einer geeigneten Kondensationsvorrichtung wurde die Reaktionsmischung unter Rückfluss erhitzt, zu welchem Punkt die Suspension zu einer klaren Lösung wurde. Das Ölbad wurde bei 85°C eingestellt. Nach 45 Minuten wurde ein weißer Feststoff aus der Lösung ausgefällt. Die Reaktionsmischung wurde unter Rückfluss 4 Stunden lang gerührt, ehe sie auf –20°C abgekühlt wurde. Der weiße Feststoff setzte sich auf dem Boden ab. Die obere klare Ethanollösung wurde dekantiert. Der Rest wurde zwei Mal mit kaltem Ethanol gewaschen. Die vereinigte Etherlösung wurde konzentriert und über Nacht über Vakuum getrocknet. 12,4 g von öligem N1,N4-Dioleyl-N1,N4-di-[2-hydroxy-3-(N-aminopropyl)]-diaminobutan wurden erhalten.
- Die nachfolgenden Verbindungen wurden durch das obige Verfahren unter Verwendung des entsprechenden Diamins und eines langkettigen Acylchlorids synthetisiert:
N1,N4-Dimyristyl-N1,N4-di-[2-hydroxy-3-(N-aminopropyl)]-diaminobutan;
N1,N4-Dipalmityl-N1,N4-di-[2-hydroxy-3-(N-aminopropyl)]-diaminobutan;
N1,N4-Dipalmitolyl-N1,N4-di-[2-hydroxy-3-(N-aminopropyl)]-diaminobutan;
N1,N4-Distearyl-N1,N4-di-[2-hydroxy-3-(N-aminopropyl)]-diaminobutan;
N1,N4-Dilauryl-N1,N4-di-[2-hydroxy-3-(N-aminopropyl)]-diaminobutan;
N1,N2-Dimyristyl-N1,N2-di-[2-hydroxy-3-(N-aminopropyl)]-diaminoethan;
N1,N2-Dipalmityl-N1,N2-di-[2-hydroxy-3-(N-aminopropyl)-diaminoethan;
N1,N2-Dipalmitolyl-N1,N2-di-[2-hydroxy-3-(N-aminopropyl)]-diaminoethan;
N1,N2-Distearyl-N1,N2-di-[2-hydroxy-3-(N-aminopropyl)]-diaminoethan;
N1,N2-Dilauryl-N1,N2-di-[2-hydroxy-3-(N-aminopropyl)]-diaminoethan;
N1,N2-Dioleyl-N1,N2-di-[2-hydroxy-3-(N-aminopropyl)]-diaminoethan;
N1,N9-Dimyristyl-N1,N9-di-[2-hydroxy-3-(N-aminopropyl)]-Jeffamin;
N1,N9-Dipalmityl-N1,N9-di-[2-hydroxy-3-(N-aminopropyl)]-Jeffamin;
N1,N9-Dipalmitolyl-N1,N9-di-[2-hydroxy-3-(N-aminopropyl)]-Jeffamin;
N1,N9-Distearyl-N1,N9-di-[2-hydroxy-3-(N-aminopropyl)]-Jeffamin;
N1,N9-Dilauryl-N1,N9-di-[2-hydroxy-3-(N-aminopropyl)]-Jeffamin;
N1,N9-Dioleyl-N1,N9-di-[2-hydroxy-3-(N-aminopropyl)]-Jeffamin. Synthese von Dihydroxy-dioleyol-dispermincarboxamidospermin und Analoga (Schema 1) - Beispiel 2
- Synthese von polymeren Analoga
- Polymere Analoga der vorliegenden Erfindung können unter Verwendung polymerer Amine wie etwa PEI als Ausgangsmaterial oder dendrimerer Polyamine synthetisiert werden. Zum Beispiel kann PEI mit Alkyloylchlorid acyliert werden (z. B. Oleoylchlorid) und das acylierte PEI kann dann mit Lithiumaluminiumhydrid reduziert werden, um Verbindungen der Erfindung zu erhalten.
- Obgleich die obigen Verfahren die Synthese von spezifischen Verbindungen exemplifiziert, stellen die Reaktionsschemen ein allgemeines Verfahren für das Herstellen einer Vielzahl von Verbindungen gemäß der vorliegenden Erfindung bereit. Der Durchschnittsfachmann wird schätzen, dass alternative Verfahren und Reagenzien, bei denen es sich um andere handelt, als um jene, die hierin spezifisch detailliert dargestellt werden, eingesetzt oder ohne weiteres angepasst werden können, um Verbindungen der Erfindung zu produzieren.
- Die Verbindungen der vorliegenden Erfindung können auf dieselbe Art und Weise wie Verbindungen im Stand der Technik wie etwa DOTMA, DOTAP, DOGS, DOSPA und dergleichen verwendet werden. Verfahren für das Inkorporieren solcher kationischer Lipide in Lipid-Aggregate sind im Stand der Technik hinreichend bekannt. Repräsentative Verfahren werden von Felgner, et al., oben; Eppstein et al. oben; Behr et al. oben; Bangham, A. et al. (1965) M. Mol. Biol. 23: 238–252; Olson, F. et al. (1979) Biochim. Biophys. Acta 557: 9–23; Szoka, F. et al. (1978) Proc. Natl. Acad. Sci. USA 75: 4194–4198; Mayhew, E. et al. (1984) Biochim. Biophys. Acta 775: 169–175; Kim, S. et al. (1983) Biochim. Biophys. Acta 728: 339–348; und Fukunaga, M. et al. (1984) Endocrinol. 115: 757–761, offenbart. Techniken für das Herstellen von Lipid-Aggregaten geeigneter Größe für das Verwenden als Transportvehikel schließen Beschallung und Einfrieren und Auftauen sowie Extrusion, was möglicherweise am häufigsten verwendet wird, ein. Siehe z. B. Mayer, L. et al. (1986) Biochim. Biophys. Acta 858: 161–168. Mikrofluidisierung wird verwendet, wenn konsistent kleine (50–200 nm) und relativ einheitliche Aggregate erwünscht werden (Mayhew, E., oben). Aggregate im Bereich von ungefähr 50 nm bis ungefähr 200 nm im Durchmesser werden bevorzugt; allerdings sind sowohl größer als auch kleiner dimensionierte Aggregate funktional.
- Verfahren für das Transfizieren und Transportieren weiterer Verbindungen sind im Stand der Technik hinreichend bekannt. Die Verbindungen und Zusammensetzungen der vorliegenden Erfindungen ergeben Lipid-Aggregate, die in denselben Prozessen, die für weitere bekannte Transfektionsagenzien verwendet werden, verwendet werden.
- Dem Durchschnittsfachmann ist ohne weiteres ersichtlich, dass eine Anzahl von allgemeinen Parametern für die optimale Wirksamkeit von Transfektion oder Transport wichtig ist. Diese Parameter schließen zum Beispiel die Konzentration von kationischem Lipid, die Konzentration von der abzugebenden Verbindung, die Anzahl an transfizierten Zellen, das für das Transportieren eingesetzte Medium, die Länge der Zeit, während derer die Zellen mit dem Komplex Polyanion-Lipid inkubiert werden und die relative Mengen von kationischem und nicht-kationischem Lipid ein. Es kann von Nöten sein, diese Parameter für jede besondere Zellart zu optimieren. Solche Optimierung ist Routine, welche die hierin bereitgestellte Anleitung und dem im Allgemeinen im Stand der Technik zugänglichen Wissensstand einsetzt.
- Das Verwenden von repräsentativen Verbindungen der Erfindung wird durch Bezugnahme auf die nachfolgenden Beispiele weiter detailliert. Alle hierin verwendeten Abkürzungen sind standardmäßige Abkürzungen im Stand der Technik. Spezifische, nicht im Detail beschriebene Vorgänge werden entweder als Bezugnahme oder im Stand der Technik hinreichend bekannt angesehen.
- Beispiel 3
- Dieses Beispiel vergleicht Transfektion von HEK-293 (Zelllinie aus menschlichen embryonalen Nierenzellen), COS-7 (SV40 transformierte Affenzelllinie), CHO-K1 (Zelllinie vom Chinese Hamster Ovary) und HeLa (menschliche Zelllinie aus Zervixkarzinom) Zellen mit der β-Galaktosidase-Reporter-Plasmid DNA pCMV-SPORT-β-gal (LifeTechnologies, Rockville, MD) unter Verwendung von im Handel erhältlichen kationischen Lipid-Transfektionsreagenzien und der Verbindungen der vorliegenden Erfindung.
- Die Zellen wurden am Tag vor der Transfektion in 24-Well-Gewebekulturplatten in einem Gesamtvolumen von 0,4 ml DMEM (Dulbecco's Modified Eagle's Medium, Life Technologies, Rockville, MD) Kulturmedium, das eine 1%ige nicht-essentielle Aminosäure (NEAA) Lösung (LifeTechnologies) und 10% FBS enthält, plattiert. Bei den HEK-293 und den COS-7 Zellen wurden die Gewebekulturplatten erneut mit Poly-L-Lysin beschichtet, um Zellbindung zu verstärken.
- Am nächsten Tag wurden die Komplexe DNA-Transfektionsreagens wie folgt hergestellt:
Die kationischen Lipid-Reagenzien und DNA wurden separat in 25 μl Aliquoten serumfreies DMEM, das 1%ige NEAA enthält, verdünnt. Bei LipofectAMINE PLUS wurden 7–14 μl PLUS Reagent zu der DNA hinzugefügt, vermischt und 15 Minuten lang bei Raumtemperatur inkubiert. Die verdünnte DNA wurde mit dem verdünnten Lipid vereinigt und bei Raumtemperatur zumindest 15 Minuten lang inkubiert, damit die DNA und das Lipid Komplexe bilden können. Nach dieser Inkubation wurden die Komplexe tröpfchenweise direkt zu dem Kulturmedium hinzugefügt und durch Vor- und Rückschwingen der Kulturplatte gemischt. Die Zellen wurden weiter beí 37°C insgesamt 24 Stunden lang inkubiert, um Expression des durch das Reporterplasmid pCMV-SPORT-β-gal codierten lacZ Transgens zu ermöglichen. 24 Stunden nach der Transfektion wurden Wachstumsmedium und Transfektionskomplexe von den Wells entfernt und die Zellen in jedem Well wurden kurz mit 1 ml D-PBS (Dulbecco's PBS, Life Technologies, Rockville, MD) gespült. Die Zellen in jedem Well wurden durch das Hinzufügen von 0,15 bis 2,0 ml 0,1% Tris, pH 8,0, das 0,1 M Triton X-100 enthält, lysiert. Die Platten wurden bei –80°C für mindestens 2 Stunden eingefroren und bei Raumtemperatur oder 37°C aufgetaut. Die aufgetauten Zelllysate wurden durch Zentrifugieren geklärt und die Überstände wurden auf β-gal Aktivität hin unter Verwendung des enzymatischen Substrats ONPG untersucht. Die Konzentration des gesamten Proteins in Zelllysaten wurde ebenfalls unter Verwendung eines Bradford-Assays (Bio-Rad Laboratories, Hercules, CA) bestimmt. Die β-gal Aktivität in transfizierten Zellextrakten wurde gegen eine Standardkurve berechnet und als ng β-gal pro Oberfläche von Gewebekulturplatte (ng/cm2), um die Gesamtaktivität pro Transfektion zu reflektieren, oder als ng β-gal pro μg gesamtes Protein (ng/μg), um spezifische Aktivität zu reflektieren, ausgedrückt. - HEK-293 (
1 ), COS-7 (2 ), CHO-K1 (3 ) und HeLa (4 ) Zellen wurden mit 0,4 oder 0,8 μg pCMV-SPORT-β-gal DNA und 0,2 bis 4,0 μl Transfektionsreagens transfiziert. Bei den untersuchten Transfektionsreagenzien handelte es sich um die folgenden: DHDOS (IV), formuliert bei 2 mg/ml mit dem neutralen Co-Lipid Cholesterin (bei einem Verhältnis von 1:15 (M/M) DHDOS zu Cholesterin); DHDOS, formuliert bei 2 mg/ml mit dem neutralen Co-Lipid DOPE (Dioleylphosphatidylethanolamin) (bei einem Verhältnis von 1:1 (M/M) DHDOS zu DOPE); LipofectAMINE PLUS (Life Technologies, Rockville MD); und FuGENETM-6 (Boehringer Mannheim, Deutschland). DHDOS Formulierungen wurden in dem Bereich von 0,2 bis 1,5 μl untersucht, LipofectAMINE PLUS und FuGENE-6 wurden in dem Bereich von 0,2 bis 4,0 μl untersucht. FuGENE-6 wurde gemäß dem vom Hersteller empfohlenen Protokoll verwendet. DHDOS und LipofectAMINE PLUS wurden gemäß dem obigen Protokoll verwendet. Die in den Figuren angeführten Daten wurden als Gesamtaktivität (ng/cm2) ausgedrückt, um die Gesamtexpression der transfizierten DNA besser zu vergleichen. Lediglich die Daten mit 0,8 μg DNA werden gezeigt, da mit 0,4 und 0,8 μg DNA ähnliche Ergebnisse erzielt wurden. - Sämtliche in dieser Beschreibung angeführten Veröffentlichungen, Patente und Patentanmeldungen sind indikativ für den Wissensstand des Fachmanns auf dem Gebiet der Technik, zu dem die Erfindung gehört.
Claims (35)
- Eine Verbindung mit der folgenden Formel: worin es sich bei Q um N handelt; es sich bei L um ein bivalentes, organisches Radikal handelt, das in der Lage ist, jedes Q zu binden; R1, R3, R4 und R6 unabhängig voneinander ausgewählt werden aus der Gruppe bestehend aus H und C8-C24 Alkenyl, C8-C24 Aryl und C8-C24 Alkyl, optional substituiert mit einem oder mehr als einem Element ausgewählt aus einem Alkohol, einem Amin, einem Amid, einem Ether, einem Polyether, einem Polyamid, einem Ester, einem Mercaptan, einem Harnstoff, einem Thioharnstoff, einem Guanidyl oder einer Carbamoylgruppe; und worin es sich bei zumindest einem Element aus R1, R3, R4 und R6 um eine geradkettige oder verzweigte Alkyl- oder Alkenylgruppe oder eine Arylgruppe handelt; es sich bei X– um ein physiologisch annehmbares Anion handelt; es sich bei a um eine Zahl positiver Ladung, dividiert durch die Valenz von X, handelt; es sich bei r, s, u und y um 0 oder 1 handelt, vorausgesetzt, die Valenzanforderungen von Stickstoff sind erfüllt; und es sich bei R7 und R8 um H handelt.
- Die Verbindung wie in einem der Ansprüche 1, 2 und 4 beansprucht, wobei R1, R3, R4 und R6 ausgewählt aus diesen optional substituierten Alkylgruppen werden.
- Die Verbindung wie in Anspruch 1, Anspruch 2 oder Anspruch 4 beansprucht, wobei R1, R3, R4 und R6 unabhängig voneinander ausgewählt werden aus der Gruppe bestehend aus H, C8-C24 Alkenyl und C8-C24 Alkyl.
- Eine Zusammensetzung, die eine oder mehr als eine Verbindung aus einem der Ansprüche 1 bis 10 umfasst.
- Eine Zusammensetzung aus Anspruch 12, die ferner zumindest eine zusätzliche Komponente ausgewählt aus der Gruppe bestehend aus einer Zelle, Zellen, einer Zellkultur, einem Zellkulturmedium, einem neutralen Lipid, einer Nukleinsäure und einem Transfektionsverstärker umfasst.
- Die Zusammensetzung aus Anspruch 13, die eine Nukleinsäure umfasst.
- Die Zusammensetzung aus Anspruch 13 oder Anspruch 14, wobei es sich bei der zumindest einen zusätzlichen Komponente um ein neutrales Lipid handelt.
- Die Zusammensetzung aus Anspruch 15, wobei es sich bei dem neutralen Lipid um DOPE, DOPC oder Cholesterin handelt.
- Ein Lipid-Aggregat, das eine oder mehr als eine Verbindung aus einem der Ansprüche 1 bis 10 umfasst.
- Das Lipid-Aggregat aus Anspruch 17, das zumindest ein neutrales Lipid umfasst.
- Das Lipid-Aggregat aus Anspruch 18, wobei diese das Lipid-Aggregat bildende Verbindung ausgewählt wird aus der Gruppe bestehend aus DOPE, DOPC und Cholesterin.
- Ein Kit, das eine oder mehr als eine Verbindung aus einem der Ansprüche 1 bis 10 und zumindest eine zusätzliche Komponente ausgewählt aus der Gruppe bestehend aus einer Zelle, Zellen, einem Zellkulturmedium, einer Nukleinsäure, einem Transfektionsverstärker und Instruktionen für das Transfizieren einer Zelle oder von Zellen umfasst.
- Ein Verfahren für das in vitro Einbringen eines Polyanions in eine Zelle oder in Zellen, wobei dieses Verfahren das Bilden eines Lipid-Aggregats aus einer positiv geladenen Verbindung aus einem der Ansprüche 1 bis 10, das Kontaktieren des Lipid-Aggregats mit einem Polyanion für das Bilden eines positiv geladenen Komplexes aus Polyanion und Liposom und das Inkubieren des Komplexes mit einer Zelle oder Zellen umfasst.
- Das Verfahren aus Anspruch 21, wobei es sich bei dem Polyanion um eine Nukleinsäure handelt.
- Das Verfahren aus Anspruch 21 oder Anspruch 22, wobei es sich bei dem Lipid-Aggregat um ein Liposom handelt.
- Eine Zusammensetzung für das Verwenden in Transfektionsverfahren, die folgendes umfasst: ein physiologisches Medium; eine polykationische Verbindung; und ein physiologisch annehmbares Anion in einer Anzahl, die geeignet ist, um die kationischen Ladungen dieser Verbindung auszugleichen, wobei die polykationische Verbindung die folgende Formel aufweist: worin es sich bei Q um N handelt; es sich bei L um ein bivalentes, organisches Radikal handelt, das in der Lage ist, jedes Q zu binden; R1, R3, R4 und R6 unabhängig voneinander ausgewählt werden aus der Gruppe bestehend aus H und C8-C24 Alkenyl, C8-C24 Aryl oder C8-C24 Alkyl, optional mit einem oder mehr als einem Element ausgewählt aus einem Alkohol, einem Amin, einem Amid, einem Ether, einem Polyether, einem Polyamid, einem Ester, einem Mercaptan, einem Harnstoff, einem Thioharnstoff, einem Guanidyl oder einer Carbamoylgruppe; und worin es sich bei zumindest einem Element aus R1, R3, R4 und R6 um eine geradkettige oder verzweigte Alkyl- oder Alkenylgruppe oder eine Arylgruppe handelt; es sich bei r, s, u und y um 0 oder 1 handelt, vorausgesetzt, die Valenzanforderungen von Stickstoff sind erfüllt und die Verbindung ist polykationisch; es sich bei R7 und R8 um H handelt.
- Die Zusammensetzung wie in einem der Ansprüche 24, 25 und 27 beansprucht, wobei R1, R3, R4 und R6 ausgewählt werden aus diesen optional substituierten Alkylgruppen.
- Die Zusammensetzung aus Anspruch 24 oder Anspruch 25, wobei R1, R3, R4 und R6 ausgewählt werden aus der Gruppe bestehend aus H, C8-C24 Alkenyl, C8-C24 Aryl und C8-C24 Alkyl.
- Die Verwendung einer Zusammensetzung aus einem der Ansprüche 24 bis 34 für das in vitro Transfizieren einer Nukleinsäure in eine Zelle oder in Zellen.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US10811798P | 1998-11-12 | 1998-11-12 | |
| US108117P | 1998-11-12 | ||
| PCT/US1999/026825 WO2000027795A1 (en) | 1998-11-12 | 1999-11-12 | Transfection reagents |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| DE69937964D1 DE69937964D1 (de) | 2008-02-21 |
| DE69937964T2 true DE69937964T2 (de) | 2009-01-02 |
Family
ID=22320415
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| DE69937964T Expired - Lifetime DE69937964T2 (de) | 1998-11-12 | 1999-11-12 | Transportreagentien |
Country Status (13)
| Country | Link |
|---|---|
| US (12) | US7166745B1 (de) |
| EP (3) | EP1129064B1 (de) |
| JP (2) | JP4854853B2 (de) |
| AT (1) | ATE383331T1 (de) |
| AU (1) | AU772847B2 (de) |
| CA (1) | CA2350882C (de) |
| CY (1) | CY1107895T1 (de) |
| DE (1) | DE69937964T2 (de) |
| DK (1) | DK1129064T3 (de) |
| ES (1) | ES2296419T3 (de) |
| NZ (1) | NZ512244A (de) |
| PT (1) | PT1129064E (de) |
| WO (1) | WO2000027795A1 (de) |
Families Citing this family (131)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5674908A (en) | 1993-12-20 | 1997-10-07 | Life Technologies, Inc. | Highly packed polycationic ammonium, sulfonium and phosphonium lipids |
| US6989434B1 (en) | 1994-02-11 | 2006-01-24 | Invitrogen Corporation | Reagents for intracellular delivery of macromolecules |
| US5795587A (en) * | 1995-01-23 | 1998-08-18 | University Of Pittsburgh | Stable lipid-comprising drug delivery complexes and methods for their production |
| US20030069173A1 (en) * | 1998-03-16 | 2003-04-10 | Life Technologies, Inc. | Peptide-enhanced transfections |
| EP1129064B1 (de) | 1998-11-12 | 2008-01-09 | Invitrogen Corporation | Transportreagentien |
| US6696424B1 (en) | 1999-05-28 | 2004-02-24 | Vical Incorporated | Cytofectin dimers and methods of use thereof |
| GB9914085D0 (en) * | 1999-06-16 | 1999-08-18 | Smithkline Beecham Plc | New use |
| GB9914045D0 (en) * | 1999-06-16 | 1999-08-18 | Smithkline Beecham Plc | Novel compounds |
| US7294511B2 (en) | 2001-03-22 | 2007-11-13 | Chromos Molecular Systems, Inc. | Methods for delivering nucleic acid molecules into cells and assessment thereof |
| US20030096414A1 (en) | 2001-03-27 | 2003-05-22 | Invitrogen Corporation | Culture medium for cell growth and transfection |
| US6741357B2 (en) * | 2001-08-14 | 2004-05-25 | Seagate Technology Llc | Quadrature phase shift interferometer with unwrapping of phase |
| US20060148734A1 (en) * | 2002-03-27 | 2006-07-06 | Patrick Camilleri | Diaminoacid-aminoacid-polyamine based gemini surfactant compounds |
| ES2354607T3 (es) | 2002-06-28 | 2011-03-16 | Protiva Biotherapeutics Inc. | Procedimiento y aparato para producir liposomas. |
| CA2502285A1 (en) * | 2002-10-16 | 2004-05-13 | Neopharm, Inc. | Cardiolipin molecules and method of synthesis |
| EP1628647A4 (de) | 2003-05-22 | 2007-10-24 | Molecular Transfer Inc | Neue lipide zur transfektion von nukleinsäuren |
| CA2551022C (en) | 2003-09-15 | 2013-06-04 | Protiva Biotherapeutics, Inc. | Polyethyleneglycol-modified lipid compounds and uses thereof |
| EP1689444A4 (de) * | 2003-10-24 | 2007-08-08 | Univ Saskatchewan | Dna-abgabe mit gemini kationischen tensiden |
| US7691607B2 (en) * | 2004-02-09 | 2010-04-06 | The Regents Of The University Of California | Expression system of NELL peptide |
| WO2005121348A1 (en) * | 2004-06-07 | 2005-12-22 | Protiva Biotherapeutics, Inc. | Lipid encapsulated interfering rna |
| GB0413613D0 (en) * | 2004-06-17 | 2004-07-21 | Univ London | Small molecule carriers |
| AU2005306533B2 (en) * | 2004-11-17 | 2012-05-31 | Arbutus Biopharma Corporation | siRNA silencing of apolipoprotein B |
| US20070117179A1 (en) * | 2005-09-27 | 2007-05-24 | Invitrogen Corporation | In vitro protein synthesis systems for membrane proteins that include adolipoproteins and phospholipid-adolipoprotein particles |
| TW200800235A (en) * | 2005-10-18 | 2008-01-01 | Otsuka Pharma Co Ltd | Carrier composition for nucleic acid transport |
| CN101346393B (zh) | 2005-11-02 | 2015-07-22 | 普洛体维生物治疗公司 | 修饰的siRNA分子及其应用 |
| WO2007053235A1 (en) * | 2005-11-04 | 2007-05-10 | Sachem, Inc. | Cation-exchange displacement chromatography process and cationic organic compounds for use as displacer compounds in cation-exchange displacement chromatography process |
| DE102006008701A1 (de) * | 2006-02-23 | 2007-08-30 | Qiagen Gmbh | Ein Verfahren zur Herstellung einer transformierten Zelle |
| CA2960570C (en) | 2006-05-05 | 2018-05-08 | Molecular Transfer, Inc. | Lipids for transfection of eukaryotic cells |
| WO2008040792A2 (en) * | 2006-10-04 | 2008-04-10 | Centre National De La Recherche Scientifique (Cnrs) | Compositions comprising a sirna and lipidic 4,5-disubstituted 2-deoxystreptamine ring aminoglycoside derivatives and uses thereof |
| WO2008106660A2 (en) * | 2007-03-01 | 2008-09-04 | Invitrogen Corporation | Isolated phospholipid-protein particles |
| TWI428135B (zh) | 2007-03-26 | 2014-03-01 | Hirofumi Takeuchi | And a carrier composition for quick-acting nucleic acid delivery |
| GB0720486D0 (en) * | 2007-10-19 | 2007-11-28 | Univ Edinburgh | Cationic lipids |
| UA97559C2 (uk) | 2007-11-08 | 2012-02-27 | Оцука Фармасьютікал Ко., Лтд. | Комплекс нуклеїнової кислоти і композиція для доставки нуклеїнової кислоти |
| ES2535419T3 (es) * | 2007-12-27 | 2015-05-11 | Protiva Biotherapeutics Inc. | Silenciamiento de expresión de quinasa tipo polo usando ARN interferente |
| WO2009086558A1 (en) * | 2008-01-02 | 2009-07-09 | Tekmira Pharmaceuticals Corporation | Improved compositions and methods for the delivery of nucleic acids |
| JP5475753B2 (ja) | 2008-04-15 | 2014-04-16 | プロチバ バイオセラピューティクス インコーポレイティッド | 核酸送達用の脂質製剤 |
| EP2743265B1 (de) | 2008-10-09 | 2017-03-15 | Arbutus Biopharma Corporation | Verbesserte Aminolipide und Verfahren zur Freisetzung von Nukleinsäuren |
| EP3207944B1 (de) * | 2008-11-10 | 2020-01-15 | Arbutus Biopharma Corporation | Neuartige lipide und zusammensetzungen zur verabreichung von therapeutika |
| US8722082B2 (en) | 2008-11-10 | 2014-05-13 | Tekmira Pharmaceuticals Corporation | Lipids and compositions for the delivery of therapeutics |
| WO2010083615A1 (en) | 2009-01-26 | 2010-07-29 | Protiva Biotherapeutics, Inc. | Compositions and methods for silencing apolipoprotein c-iii expression |
| WO2010101226A1 (ja) | 2009-03-04 | 2010-09-10 | 大塚製薬株式会社 | 核酸複合体、及び核酸送達用組成物 |
| ES2613498T3 (es) | 2009-07-01 | 2017-05-24 | Protiva Biotherapeutics Inc. | Nuevas formulaciones de lípidos para el suministro de agentes terapéuticos a tumores sólidos |
| WO2011000106A1 (en) | 2009-07-01 | 2011-01-06 | Protiva Biotherapeutics, Inc. | Improved cationic lipids and methods for the delivery of therapeutic agents |
| US9018187B2 (en) | 2009-07-01 | 2015-04-28 | Protiva Biotherapeutics, Inc. | Cationic lipids and methods for the delivery of therapeutic agents |
| WO2011011447A1 (en) * | 2009-07-20 | 2011-01-27 | Protiva Biotherapeutics, Inc. | Compositions and methods for silencing ebola virus gene expression |
| US8455455B1 (en) | 2010-03-31 | 2013-06-04 | Protiva Biotherapeutics, Inc. | Compositions and methods for silencing genes involved in hemorrhagic fever |
| US9006417B2 (en) | 2010-06-30 | 2015-04-14 | Protiva Biotherapeutics, Inc. | Non-liposomal systems for nucleic acid delivery |
| US8466122B2 (en) | 2010-09-17 | 2013-06-18 | Protiva Biotherapeutics, Inc. | Trialkyl cationic lipids and methods of use thereof |
| US20120136073A1 (en) | 2010-11-15 | 2012-05-31 | Life Technologies Corporation | Amine-Containing Transfection Reagents and methods for making and using same |
| WO2012078667A2 (en) | 2010-12-06 | 2012-06-14 | The Penn State Research Foundation | Compositions and methods relating to proliferative diseases |
| US8695618B2 (en) | 2010-12-22 | 2014-04-15 | Carnegie Mellon University | 3D chemical pattern control in 2D fluidics devices |
| WO2012142622A1 (en) | 2011-04-15 | 2012-10-18 | Molecular Transfer, Inc. | Agents for improved delivery of nucleic acids to eukaryotic cells |
| CN102319550B (zh) * | 2011-07-08 | 2014-01-22 | 中国林业科学研究院林产化学工业研究所 | 一种低浓度粘弹表面活性剂溶液及其制备方法 |
| JP6261500B2 (ja) | 2011-07-22 | 2018-01-17 | プレジデント アンド フェローズ オブ ハーバード カレッジ | ヌクレアーゼ切断特異性の評価および改善 |
| WO2013073480A1 (ja) | 2011-11-18 | 2013-05-23 | 日油株式会社 | 細胞内動態を改善したカチオン性脂質 |
| CA2859387A1 (en) | 2011-12-16 | 2013-06-20 | Moderna Therapeutics, Inc. | Modified nucleoside, nucleotide, and nucleic acid compositions |
| US9035039B2 (en) | 2011-12-22 | 2015-05-19 | Protiva Biotherapeutics, Inc. | Compositions and methods for silencing SMAD4 |
| KR102136698B1 (ko) | 2012-05-02 | 2020-07-22 | 라이프 테크놀로지스 코포레이션 | 고밀도 성장 및 형질감염 배지 및 발현 인핸서의 독특한 페어링을 사용하는 포유동물 세포들 내의 고수율의 일시적 발현 |
| US9758606B2 (en) | 2012-07-31 | 2017-09-12 | The Trustees Of Columbia University In The City Of New York | Cyclopropenium polymers and methods for making the same |
| ES2902839T3 (es) * | 2012-10-08 | 2022-03-30 | Biontech Delivery Tech Gmbh | Derivados de poliaminas carboxiladas como reactivos de transfección |
| EP2912045A4 (de) | 2012-10-29 | 2016-07-13 | Molecular Transfer Inc | Polykationische methylphospholipide zur verbesserten freisetzung von nukleinsäuren in eukaryotischen zellen |
| ITRM20130054A1 (it) * | 2013-01-30 | 2014-07-31 | Paolo Gresele | Piastrine trasfettate con materiale genetico esogeno e microparticelle derivate da dette piastrine trasfettate, metodo per la loro preparazione e loro usi. |
| CA2905696A1 (en) | 2013-03-15 | 2014-09-18 | The Penn State Research Foundation | Compositions and methods including leelamine and arachidonyl trifluoromethyl ketone relating to treatment of cancer |
| EP3003295A1 (de) | 2013-03-15 | 2016-04-13 | The Penn State Research Foundation | Zusammensetzungen und verfahren mit celecoxib und plumbagin zur behandlung von krebs |
| EP3013964B1 (de) * | 2013-06-28 | 2020-05-06 | ethris GmbH | Zusammensetzungen zur einführung von rns in zellen |
| US20150044192A1 (en) | 2013-08-09 | 2015-02-12 | President And Fellows Of Harvard College | Methods for identifying a target site of a cas9 nuclease |
| US9359599B2 (en) | 2013-08-22 | 2016-06-07 | President And Fellows Of Harvard College | Engineered transcription activator-like effector (TALE) domains and uses thereof |
| US9322037B2 (en) | 2013-09-06 | 2016-04-26 | President And Fellows Of Harvard College | Cas9-FokI fusion proteins and uses thereof |
| US9340800B2 (en) | 2013-09-06 | 2016-05-17 | President And Fellows Of Harvard College | Extended DNA-sensing GRNAS |
| US9526784B2 (en) * | 2013-09-06 | 2016-12-27 | President And Fellows Of Harvard College | Delivery system for functional nucleases |
| AU2014346559B2 (en) | 2013-11-07 | 2020-07-09 | Editas Medicine,Inc. | CRISPR-related methods and compositions with governing gRNAs |
| EP3756690A3 (de) | 2013-12-12 | 2021-03-17 | Life Technologies Corporation | Membranpenetrierende peptide zur erhöhung der transfektion und zusammensetzungen und verfahren zur verwendung davon |
| US9840699B2 (en) | 2013-12-12 | 2017-12-12 | President And Fellows Of Harvard College | Methods for nucleic acid editing |
| EP3169310A1 (de) | 2014-07-15 | 2017-05-24 | Life Technologies Corporation | Zusammensetzungen mit lipidaggregaten und verfahren zur effizienten bereitstellung von molekülen an zellen |
| CA2956224A1 (en) | 2014-07-30 | 2016-02-11 | President And Fellows Of Harvard College | Cas9 proteins including ligand-dependent inteins |
| US9816080B2 (en) | 2014-10-31 | 2017-11-14 | President And Fellows Of Harvard College | Delivery of CAS9 via ARRDC1-mediated microvesicles (ARMMs) |
| BR112017009505A2 (pt) * | 2014-11-10 | 2018-02-06 | Ethris Gmbh | composição farmacêutica, e, matriz ou suporte. |
| WO2016112963A1 (en) | 2015-01-13 | 2016-07-21 | Riboxx Gmbh | Delivery of biomolecules into cells |
| CA2975371C (en) * | 2015-01-30 | 2024-02-13 | Nof Corporation | Cationic lipid for nucleic acid delivery |
| AU2016218977C1 (en) | 2015-02-13 | 2023-03-23 | Factor Bioscience Inc. | Nucleic acid products and methods of administration thereof |
| CN104876831B (zh) * | 2015-04-03 | 2017-05-17 | 苏州圣诺生物医药技术有限公司 | 脂质修饰精胺衍生物及利用该衍生物制备的脂质体 |
| CN107922961A (zh) | 2015-07-13 | 2018-04-17 | 生命技术公司 | 用于cho细胞中经改善的瞬时蛋白质表达的系统和方法 |
| US11085056B2 (en) | 2015-08-28 | 2021-08-10 | Molecular Transfer, Inc. | Transfection complexes and methods of using the same |
| EP3141582B1 (de) * | 2015-09-10 | 2018-06-13 | Karlsruher Institut für Technologie | Synthese und verwendung von polyalkylaminen |
| JP2018532404A (ja) | 2015-10-14 | 2018-11-08 | ライフ テクノロジーズ コーポレーション | リボ核タンパク質トランスフェクション薬剤 |
| IL310721A (en) | 2015-10-23 | 2024-04-01 | President And Fellows Of Harvard College | Nucleobase editors and their uses |
| US10538784B2 (en) | 2016-03-01 | 2020-01-21 | Molecular Transfer, Inc. | Plant virus movement proteins and methods of using the same |
| KR20230095129A (ko) | 2016-08-03 | 2023-06-28 | 프레지던트 앤드 펠로우즈 오브 하바드 칼리지 | 아데노신 핵염기 편집제 및 그의 용도 |
| CN109804066A (zh) | 2016-08-09 | 2019-05-24 | 哈佛大学的校长及成员们 | 可编程cas9-重组酶融合蛋白及其用途 |
| CN116115629A (zh) | 2016-08-17 | 2023-05-16 | 菲克特生物科学股份有限公司 | 核酸产品及其施用方法 |
| US11542509B2 (en) | 2016-08-24 | 2023-01-03 | President And Fellows Of Harvard College | Incorporation of unnatural amino acids into proteins using base editing |
| US11730823B2 (en) | 2016-10-03 | 2023-08-22 | President And Fellows Of Harvard College | Delivery of therapeutic RNAs via ARRDC1-mediated microvesicles |
| KR20240007715A (ko) | 2016-10-14 | 2024-01-16 | 프레지던트 앤드 펠로우즈 오브 하바드 칼리지 | 핵염기 에디터의 aav 전달 |
| WO2018119359A1 (en) | 2016-12-23 | 2018-06-28 | President And Fellows Of Harvard College | Editing of ccr5 receptor gene to protect against hiv infection |
| US11898179B2 (en) | 2017-03-09 | 2024-02-13 | President And Fellows Of Harvard College | Suppression of pain by gene editing |
| WO2018165629A1 (en) | 2017-03-10 | 2018-09-13 | President And Fellows Of Harvard College | Cytosine to guanine base editor |
| IL269458B2 (en) | 2017-03-23 | 2024-02-01 | Harvard College | Nucleic base editors that include nucleic acid programmable DNA binding proteins |
| US11560566B2 (en) | 2017-05-12 | 2023-01-24 | President And Fellows Of Harvard College | Aptazyme-embedded guide RNAs for use with CRISPR-Cas9 in genome editing and transcriptional activation |
| US11732274B2 (en) | 2017-07-28 | 2023-08-22 | President And Fellows Of Harvard College | Methods and compositions for evolving base editors using phage-assisted continuous evolution (PACE) |
| US11236334B2 (en) | 2017-08-22 | 2022-02-01 | National University Corporation Nagoya University | Modified polynucleotide |
| EP3676376A2 (de) | 2017-08-30 | 2020-07-08 | President and Fellows of Harvard College | Hocheffiziente baseneditoren mit gam |
| WO2019045897A1 (en) * | 2017-08-31 | 2019-03-07 | Life Technologies Corporation | CATIONIC LIPIDIC COMPOSITIONS FOR TISSUE-SPECIFIC ADMINISTRATION |
| US11795443B2 (en) | 2017-10-16 | 2023-10-24 | The Broad Institute, Inc. | Uses of adenosine base editors |
| EP3719127A4 (de) | 2017-12-01 | 2021-10-20 | Suzhou Ribo Life Science Co., Ltd. | Nukleinsäure, zusammensetzung und konjugat damit, herstellungsverfahren und verwendung |
| EP3719128A4 (de) | 2017-12-01 | 2021-10-27 | Suzhou Ribo Life Science Co., Ltd. | Doppelsträngiges oligonukleotid, zusammensetzung und konjugat mit doppelsträngigem oligonukleotid, herstellungsverfahren dafür und verwendung davon |
| KR102617947B1 (ko) | 2017-12-29 | 2023-12-27 | 쑤저우 리보 라이프 사이언스 컴퍼니, 리미티드 | 접합체와 제조 및 그 용도 |
| CN110506035B (zh) | 2018-03-16 | 2022-08-12 | 株式会社东芝 | 生物降解性化合物、脂质粒子、含有脂质粒子的组合物、和试剂盒 |
| CA3094057A1 (en) | 2018-03-27 | 2019-10-03 | Nof Corporation | Cationic lipid exhibiting improved intracellular dynamics |
| CA3097203C (en) | 2018-04-29 | 2023-09-05 | Precision Nanosystems Inc. | Compositions for transfecting resistant cell types |
| US11690921B2 (en) | 2018-05-18 | 2023-07-04 | Sangamo Therapeutics, Inc. | Delivery of target specific nucleases |
| WO2020039631A1 (ja) * | 2018-08-21 | 2020-02-27 | 株式会社 東芝 | 生分解性化合物、脂質粒子、脂質粒子を含む組成物、およびキット |
| EP3842534A4 (de) | 2018-08-21 | 2022-07-06 | Suzhou Ribo Life Science Co., Ltd. | Nukleinsäure, pharmazeutische zusammensetzung und konjugat mit der nukleinsäure sowie deren verwendung |
| WO2020063198A1 (zh) | 2018-09-30 | 2020-04-02 | 苏州瑞博生物技术有限公司 | 一种siRNA缀合物及其制备方法和用途 |
| WO2020086408A1 (en) | 2018-10-26 | 2020-04-30 | The United States Of America, As Represented By The Secretary, Department Of Health And Human Services | A high-yield perfusion-based transient gene expression bioprocess |
| EP3646854B1 (de) | 2018-10-30 | 2022-08-03 | PolyPlus Transfection | Zusammensetzungen zur transfektion von mrna in eine zelle und deren anwendungen |
| WO2020191248A1 (en) | 2019-03-19 | 2020-09-24 | The Broad Institute, Inc. | Method and compositions for editing nucleotide sequences |
| EP4223886A3 (de) | 2019-04-16 | 2023-09-13 | Genfit | Zusammensetzungen und verfahren zur stabilisierung von mikro-rna |
| US20220175723A1 (en) | 2019-04-22 | 2022-06-09 | The Penn State Research Foundation | Methods and compositions relating to inhibition of aldehyde dehydrogenases for treatment of cancer |
| AU2020301036A1 (en) * | 2019-07-03 | 2022-02-17 | Factor Bioscience Inc. | Cationic lipids and uses thereof |
| JP2021016371A (ja) * | 2019-07-23 | 2021-02-15 | 株式会社東芝 | Car−t細胞の製造方法、核酸導入キャリア及びキット |
| US10501404B1 (en) | 2019-07-30 | 2019-12-10 | Factor Bioscience Inc. | Cationic lipids and transfection methods |
| AU2020325705A1 (en) * | 2019-08-05 | 2022-03-03 | Polyplus Transfection | Compositions for transfecting a nucleic acid molecule into a cell comprising heterocyclic compounds grafted to a cationic polymer, and their applications |
| JP2023525304A (ja) | 2020-05-08 | 2023-06-15 | ザ ブロード インスティテュート,インコーポレーテッド | 標的二本鎖ヌクレオチド配列の両鎖同時編集のための方法および組成物 |
| WO2021255262A1 (en) | 2020-06-19 | 2021-12-23 | Sylentis Sau | siRNA AND COMPOSITIONS FOR PROPHYLACTIC AND THERAPEUTIC TREATMENT OF VIRUS DISEASES |
| EP3929295A1 (de) | 2020-06-26 | 2021-12-29 | Universitat Pompeu Fabra | Künstliche rnas zur modulation von rna-fragmenten |
| EP4251170A1 (de) | 2020-11-25 | 2023-10-04 | Akagera Medicines, Inc. | Lipidnanopartikel zur abgabe von nukleinsäuren und zugehörige verfahren zur verwendung |
| EP4015634A1 (de) | 2020-12-15 | 2022-06-22 | Sylentis, S.A.U. | Sirna und zusammensetzungen zur prophylaktischen und therapeutischen behandlung von viruskrankheiten |
| WO2023018990A2 (en) * | 2021-08-12 | 2023-02-16 | Life Technologies Corporation | Lipids for nucleic acid delivery |
| WO2023114901A2 (en) | 2021-12-15 | 2023-06-22 | Oxford Biomedica Solutions Llc | Methods and compositions for the production of adeno-associated virus |
| US20230392188A1 (en) | 2022-06-02 | 2023-12-07 | Perkinelmer Health Sciences, Inc. | Electrophoresis-mediated characterization of dna content of adeno-associated virus capsids |
| CN115557851B (zh) * | 2022-06-27 | 2023-04-18 | 上海云沂生物医药科技有限公司 | 一种氨基脂质、其合成方法、颗粒及用途 |
| WO2024006937A1 (en) | 2022-06-30 | 2024-01-04 | Life Technologies Corporation | Lipid compositions for in vivo delivery |
Family Cites Families (279)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US204672A (en) * | 1878-06-11 | Improvement in lubricators | ||
| US554307A (en) * | 1896-02-11 | Controller for electric motors | ||
| US6346516B1 (en) * | 1998-11-09 | 2002-02-12 | Council Of Scientific & Industrial Research | Cationic amphiphiles containing N-hydroxyalkyl group for intracellular delivery of biologically active molecules |
| US2046720A (en) * | 1933-06-09 | 1936-07-07 | Girdler Corp | Nu-hydroxy-aminoalkyl substituted alkylene diamines |
| US2654785A (en) | 1949-02-15 | 1953-10-06 | Ciba Pharm Prod Inc | Quaternated aza-pentane amines |
| US2695314A (en) | 1951-08-25 | 1954-11-23 | Monsanto Chemicals | Hydroxyethylated-n-keryl alkylenediamines |
| US2901461A (en) | 1955-05-05 | 1959-08-25 | Union Carbide Corp | Curable glycidyl polyether-polyamine compositions |
| US2933529A (en) * | 1956-01-09 | 1960-04-19 | Rohm & Haas | Symmetrical diquaternary ammonium compounds |
| FR1146332A (fr) * | 1956-03-29 | 1957-11-08 | Produits de nettoyage de la chevelure et sels de diamines bitertiaires entrant dans la composition de ces produits | |
| US2867665A (en) | 1956-07-09 | 1959-01-06 | Searle & Co | Alkylenebis [trialkylphosphonium halides] and processes for the manufacture thereof |
| GB892413A (en) | 1957-07-15 | 1962-03-28 | Nat Res Dev | Poly-onium neuromuscular blocking agents |
| NL109859C (de) * | 1957-09-27 | |||
| US3152188A (en) | 1960-11-15 | 1964-10-06 | Nalco Chemical Co | Nu-substituted polyalkylene polyamines having 2-hydroxyethyl and mono-secondary-hydroxyl hydrocarbon substituents |
| US3152168A (en) | 1961-09-05 | 1964-10-06 | Monsanto Co | Haloalkyl pentahalophenyl carbonates |
| US3324182A (en) | 1962-12-26 | 1967-06-06 | Monsanto Res Corp | Penta-alkyldialkylenetriamines |
| US3369905A (en) | 1963-03-19 | 1968-02-20 | Eastman Kodak Co | Photographic silver halide emulsions containing polyamine sensitizing agents |
| DE1617126C3 (de) * | 1967-03-01 | 1975-06-19 | Henkel & Cie Gmbh, 4000 Duesseldorf | Maschinenwaschmittel |
| IT956228B (it) | 1972-04-15 | 1973-10-10 | Snia Viscosa | Metodo ed additivi per conferire proprieta antistatiche a composi zioni poliammidiche e prodotti poliammidici ottenuti secondo tale metodo e con l impiego di tali additivi |
| DE2624527A1 (de) | 1976-06-01 | 1977-12-22 | Bayer Ag | Verfahren zur herstellung von polyurethanen |
| CH646742A5 (de) * | 1977-07-06 | 1984-12-14 | Procter & Gamble | Konzentrierte fluessige weichmacherzusammensetzung. |
| US4235871A (en) | 1978-02-24 | 1980-11-25 | Papahadjopoulos Demetrios P | Method of encapsulating biologically active materials in lipid vesicles |
| US4501728A (en) | 1983-01-06 | 1985-02-26 | Technology Unlimited, Inc. | Masking of liposomes from RES recognition |
| JPS59186943A (ja) * | 1983-04-07 | 1984-10-23 | Toyo Soda Mfg Co Ltd | ビス〔β−(N,N−ジメチルアミノ)エチル〕エ−テルの製造法 |
| US5428147A (en) | 1983-04-15 | 1995-06-27 | Mycogen Plant Science, Inc. | Octopine T-DNA promoters |
| GB8413911D0 (en) * | 1984-05-31 | 1984-07-04 | British Petroleum Co Plc | Encapsulating organic material |
| US6022950A (en) * | 1984-06-07 | 2000-02-08 | Seragen, Inc. | Hybrid molecules having translocation region and cell-binding region |
| US5208036A (en) | 1985-01-07 | 1993-05-04 | Syntex (U.S.A.) Inc. | N-(ω, (ω-1)-dialkyloxy)- and N-(ω, (ω-1)-dialkenyloxy)-alk-1-yl-N,N,N-tetrasubstituted ammonium lipids and uses therefor |
| US5049386A (en) | 1985-01-07 | 1991-09-17 | Syntex (U.S.A.) Inc. | N-ω,(ω-1)-dialkyloxy)- and N-(ω,(ω-1)-dialkenyloxy)Alk-1-YL-N,N,N-tetrasubstituted ammonium lipids and uses therefor |
| US4946787A (en) | 1985-01-07 | 1990-08-07 | Syntex (U.S.A.) Inc. | N-(ω,(ω-1)-dialkyloxy)- and N-(ω,(ω-1)-dialkenyloxy)-alk-1-yl-N,N,N-tetrasubstituted ammonium lipids and uses therefor |
| US4897355A (en) * | 1985-01-07 | 1990-01-30 | Syntex (U.S.A.) Inc. | N[ω,(ω-1)-dialkyloxy]- and N-[ω,(ω-1)-dialkenyloxy]-alk-1-yl-N,N,N-tetrasubstituted ammonium lipids and uses therefor |
| ZA8681B (en) | 1985-01-07 | 1987-08-26 | Syntex Inc | 1,2-dialkoxy-omega-trialkylammonium cationic surfactants |
| US5550289A (en) | 1985-01-07 | 1996-08-27 | Syntex (U.S.A.) Inc. | N-(1,(1-1)-dialkyloxy)-and N-(1,(1-1)-dialkenyloxy alk-1-yl-N-N,N-tetrasubstituted ammonium lipids and uses therefor |
| US4683195A (en) | 1986-01-30 | 1987-07-28 | Cetus Corporation | Process for amplifying, detecting, and/or-cloning nucleic acid sequences |
| US4965188A (en) | 1986-08-22 | 1990-10-23 | Cetus Corporation | Process for amplifying, detecting, and/or cloning nucleic acid sequences using a thermostable enzyme |
| US4683202A (en) | 1985-03-28 | 1987-07-28 | Cetus Corporation | Process for amplifying nucleic acid sequences |
| US4767699A (en) | 1985-05-02 | 1988-08-30 | Allied Corporation | Diagnostic reagent, kit and method employing polynucleotide displacement, separation, enzymatic cleavage and adenosine phosphate detection |
| AU6408586A (en) | 1985-10-03 | 1987-04-24 | Biotechnology Research Partners Limited | Novel lipoprotein-based drug-delivery systems |
| US4800159A (en) | 1986-02-07 | 1989-01-24 | Cetus Corporation | Process for amplifying, detecting, and/or cloning nucleic acid sequences |
| US4737323A (en) | 1986-02-13 | 1988-04-12 | Liposome Technology, Inc. | Liposome extrusion method |
| US4959217A (en) | 1986-05-22 | 1990-09-25 | Syntex (U.S.A.) Inc. | Delayed/sustained release of macromolecules |
| US4812449A (en) | 1986-07-03 | 1989-03-14 | Scripps Clinic And Research Foundation | In situ active compound assembly |
| JP2561478B2 (ja) | 1986-07-22 | 1996-12-11 | 武田薬品工業株式会社 | グリセリン誘導体 |
| US5560929A (en) | 1986-08-18 | 1996-10-01 | The Dow Chemical Company | Structured copolymers and their use as absorbents, gels and carriers of metal ions |
| US5338532A (en) | 1986-08-18 | 1994-08-16 | The Dow Chemical Company | Starburst conjugates |
| US5527524A (en) | 1986-08-18 | 1996-06-18 | The Dow Chemical Company | Dense star polymer conjugates |
| US5374553A (en) | 1986-08-22 | 1994-12-20 | Hoffmann-La Roche Inc. | DNA encoding a thermostable nucleic acid polymerase enzyme from thermotoga maritima |
| US5079352A (en) | 1986-08-22 | 1992-01-07 | Cetus Corporation | Purified thermostable enzyme |
| US4889818A (en) | 1986-08-22 | 1989-12-26 | Cetus Corporation | Purified thermostable enzyme |
| US4962022A (en) | 1986-09-22 | 1990-10-09 | Becton Dickinson And Company | Storage and use of liposomes |
| US5091576A (en) | 1986-12-02 | 1992-02-25 | University Of Florida | Anti-neoplastic, anti-viral or anti-retroviral spermine derivatives |
| US5342945A (en) * | 1986-12-02 | 1994-08-30 | University Of Florida Research Foundation, Inc. | Anti-neoplastic, anti-viral or anti-retroviral spermine derivatives |
| US4837028A (en) | 1986-12-24 | 1989-06-06 | Liposome Technology, Inc. | Liposomes with enhanced circulation time |
| US5264423A (en) | 1987-03-25 | 1993-11-23 | The United States Of America As Represented By The Department Of Health And Human Services | Inhibitors for replication of retroviruses and for the expression of oncogene products |
| US5276019A (en) | 1987-03-25 | 1994-01-04 | The United States Of America As Represented By The Department Of Health And Human Services | Inhibitors for replication of retroviruses and for the expression of oncogene products |
| US5166320A (en) | 1987-04-22 | 1992-11-24 | University Of Connecticut | Carrier system and method for the introduction of genes into mammalian cells |
| US4776288A (en) | 1987-07-31 | 1988-10-11 | Metallgesellschaft Aktiengesellschaft | Method for improving solids distribution in a circulating fluidized bed system |
| US5244797B1 (en) | 1988-01-13 | 1998-08-25 | Life Technologies Inc | Cloned genes encoding reverse transcriptase lacking rnase h activity |
| CA1340807C (en) | 1988-02-24 | 1999-11-02 | Lawrence T. Malek | Nucleic acid amplification process |
| US5498523A (en) | 1988-07-12 | 1996-03-12 | President And Fellows Of Harvard College | DNA sequencing with pyrophosphatase |
| US5135736A (en) | 1988-08-15 | 1992-08-04 | Neorx Corporation | Covalently-linked complexes and methods for enhanced cytotoxicity and imaging |
| US5206036A (en) * | 1988-10-19 | 1993-04-27 | E. I. Du Pont De Nemours And Company | Apparatus for shaping fiber reinforced resin matrix materials |
| US5087617A (en) | 1989-02-15 | 1992-02-11 | Board Of Regents, The University Of Texas System | Methods and compositions for treatment of cancer using oligonucleotides |
| WO1990009786A1 (en) | 1989-02-24 | 1990-09-07 | City Of Hope | Heterologous block oligomers |
| US5354844A (en) | 1989-03-16 | 1994-10-11 | Boehringer Ingelheim International Gmbh | Protein-polycation conjugates |
| US6214804B1 (en) * | 1989-03-21 | 2001-04-10 | Vical Incorporated | Induction of a protective immune response in a mammal by injecting a DNA sequence |
| DE69032284T2 (de) | 1989-03-21 | 1998-10-08 | Vical Inc | Expression von exogenen polynukleotidsequenzen in wirbeltieren |
| US5703055A (en) * | 1989-03-21 | 1997-12-30 | Wisconsin Alumni Research Foundation | Generation of antibodies through lipid mediated DNA delivery |
| US5328470A (en) | 1989-03-31 | 1994-07-12 | The Regents Of The University Of Michigan | Treatment of diseases by site-specific instillation of cells or site-specific transformation of cells and kits therefor |
| FR2645866B1 (fr) | 1989-04-17 | 1991-07-05 | Centre Nat Rech Scient | Nouvelles lipopolyamines, leur preparation et leur emploi |
| US5165925A (en) | 1989-05-02 | 1992-11-24 | State Of Oregon Acting By And Through The State Board Of Higher Education On Behalf Of Oregon State University | Vaccine for immunizing fish against infectious pancreatic necrosis virus |
| US5198423A (en) | 1989-05-26 | 1993-03-30 | Takara Shuzo Co., Ltd. | Functional polypeptide containing a cell binding domain and a heparin binding domain of fibronectin |
| US5514787A (en) | 1989-07-21 | 1996-05-07 | Washington University | DNA sequences encoding human membrane cofactor protein (MCP) |
| US5270179A (en) | 1989-08-10 | 1993-12-14 | Life Technologies, Inc. | Cloning and expression of T5 DNA polymerase reduced in 3'- to-5' exonuclease activity |
| US5047342A (en) | 1989-08-10 | 1991-09-10 | Life Technologies, Inc. | Cloning and expression of T5 DNA polymerase |
| WO1991004753A1 (en) | 1989-10-02 | 1991-04-18 | Cetus Corporation | Conjugates of antisense oligonucleotides and therapeutic uses thereof |
| BE1003510A5 (fr) | 1989-10-09 | 1992-04-07 | Fabricom Air Conditioning Sa | Composition desinfectante et procede de desinfection. |
| US5676954A (en) | 1989-11-03 | 1997-10-14 | Vanderbilt University | Method of in vivo delivery of functioning foreign genes |
| CA2068224C (en) | 1989-11-14 | 2005-01-25 | Paul A. Marks | Novel potent inducers of terminal differentiation and method of use thereof |
| US5457189A (en) | 1989-12-04 | 1995-10-10 | Isis Pharmaceuticals | Antisense oligonucleotide inhibition of papillomavirus |
| CA2070823C (en) | 1989-12-05 | 1999-01-12 | William H. Ii Frey | Neurologic agents for nasal administration to the brain |
| US5583198A (en) | 1989-12-22 | 1996-12-10 | Commonwealth Scientific And Industrial Research Organization | Amino acids, peptides or derivatives thereof coupled to fats |
| US5212295A (en) | 1990-01-11 | 1993-05-18 | Isis Pharmaceuticals | Monomers for preparation of oligonucleotides having chiral phosphorus linkages |
| US5506212A (en) | 1990-01-11 | 1996-04-09 | Isis Pharmaceuticals, Inc. | Oligonucleotides with substantially chirally pure phosphorothioate linkages |
| US4967008A (en) | 1990-01-12 | 1990-10-30 | Sherex Chemical Company, Inc. | Polyamines and their preparation |
| US5514577A (en) | 1990-02-26 | 1996-05-07 | Isis Pharmaceuticals, Inc. | Oligonucleotide therapies for modulating the effects of herpes viruses |
| US5279833A (en) | 1990-04-04 | 1994-01-18 | Yale University | Liposomal transfection of nucleic acids into animal cells |
| US5264618A (en) | 1990-04-19 | 1993-11-23 | Vical, Inc. | Cationic lipids for intracellular delivery of biologically active molecules |
| WO1993008130A1 (fr) | 1990-05-02 | 1993-04-29 | Laboratoires Mcs-Pharma S.A. | Procede de desinfection de l'eau et compositions pour sa mise en ×uvre |
| AU7979491A (en) | 1990-05-03 | 1991-11-27 | Vical, Inc. | Intracellular delivery of biologically active substances by means of self-assembling lipid complexes |
| US5602240A (en) | 1990-07-27 | 1997-02-11 | Ciba Geigy Ag. | Backbone modified oligonucleotide analogs |
| US5541307A (en) | 1990-07-27 | 1996-07-30 | Isis Pharmaceuticals, Inc. | Backbone modified oligonucleotide analogs and solid phase synthesis thereof |
| US5631329A (en) | 1990-08-27 | 1997-05-20 | Dendritech, Inc. | Process for producing hyper-comb-branched polymers |
| US5773527A (en) * | 1990-08-27 | 1998-06-30 | Dendritech, Inc. | Non-crosslinked, polybranched polymers |
| AU628690B2 (en) * | 1990-08-27 | 1992-09-17 | Pratley Investments (Proprietary) Limited | Adhesive primer |
| US5187085A (en) | 1990-09-28 | 1993-02-16 | Applied Biosystems, Inc. | Nucleic acid sequence analysis with nucleoside-5'-o-(1-thiotriphosphates) |
| DE69131321T2 (de) | 1990-09-28 | 1999-12-16 | Hoffmann La Roche | Mutationen in der 5'-3'-exonukleaseaktivität thermostabiler dna-polymerasen |
| JPH06502303A (ja) | 1990-10-05 | 1994-03-17 | バーネス,ウェーン・エム | 熱安定性dnaポリメラーゼ |
| US5186923A (en) | 1990-10-10 | 1993-02-16 | Brigham And Womens Hospital | Enhancement of cellular accumulation of lipophilic cationic organometallic compounds by reduction of intramembrane potential |
| US5589392A (en) | 1991-01-14 | 1996-12-31 | Stratagene | Nucleic acid construct encoding a nuclear transport peptide operatively linked to an inducible promoter |
| DE4102497C1 (de) | 1991-01-29 | 1992-05-07 | Mercedes-Benz Aktiengesellschaft, 7000 Stuttgart, De | |
| US5455166A (en) | 1991-01-31 | 1995-10-03 | Becton, Dickinson And Company | Strand displacement amplification |
| DE4104186A1 (de) | 1991-02-12 | 1992-08-13 | Genentech Inc | Neue, ueber endozytose in hoehere eukaryotische zellen aufnehmbare, nukleinsaeure enthaltende komplexe |
| US5977306A (en) * | 1991-02-12 | 1999-11-02 | Heska Corporation | Parasitic helminth P39 proteins, and uses thereof |
| US5328984A (en) | 1991-03-04 | 1994-07-12 | The United States As Represented By The Department Of Health & Human Services | Recombinant chimeric proteins deliverable across cellular membranes into cytosol of target cells |
| JPH07501314A (ja) | 1991-05-10 | 1995-02-09 | ハイブライドン インコーポレイテッド | 3′−末端封鎖されたオリゴヌクレオチド |
| CA2110404A1 (en) | 1991-05-31 | 1992-12-10 | Christina Teng | Human lactoferrin |
| CA2103371C (en) | 1991-06-05 | 2003-09-16 | George Y. Wu | Targeted delivery of genes encoding secretory proteins |
| CA2066540C (en) * | 1991-06-13 | 1998-01-20 | Edwin A. Kelley | Multiple user digital receiving apparatus and method with time division multiplexing |
| US6251390B1 (en) | 1991-06-17 | 2001-06-26 | Cornell Research Foundation, Inc. | Purified chitinases and use thereof |
| JP2902165B2 (ja) * | 1991-07-12 | 1999-06-07 | 三菱鉛筆株式会社 | アルコール性マーキングペンインキ組成物 |
| JPH06510036A (ja) | 1991-08-16 | 1994-11-10 | バイカル・インコーポレイテッド | 嚢胞性線維症の治療のための組成物および方法 |
| US5283185A (en) | 1991-08-28 | 1994-02-01 | University Of Tennessee Research Corporation | Method for delivering nucleic acids into cells |
| IL103059A0 (en) | 1991-09-30 | 1993-02-21 | Boehringer Ingelheim Int | Conjugates for introducing nucleic acid into higher eucaryotic cells |
| US5521291A (en) | 1991-09-30 | 1996-05-28 | Boehringer Ingelheim International, Gmbh | Conjugates for introducing nucleic acid into higher eucaryotic cells |
| NZ244306A (en) | 1991-09-30 | 1995-07-26 | Boehringer Ingelheim Int | Composition for introducing nucleic acid complexes into eucaryotic cells, complex containing nucleic acid and endosomolytic agent, peptide with endosomolytic domain and nucleic acid binding domain and preparation |
| US5196135A (en) * | 1991-10-07 | 1993-03-23 | Isp Investments Inc. | Antimicrobial, low toxicity, blend composition of bis-quaternary ammonium compounds |
| US5242684A (en) * | 1991-10-25 | 1993-09-07 | Isp Investments Inc. | Antimicrobial, low toxicity, non-irritating composition comprising a blend of bis-quaternary ammonium compounds coprecipitated with a copolymer of vinylpyrrolidone and an acrylamido or vinyl quaternary ammonium monomer |
| DE4133484A1 (de) | 1991-10-09 | 1993-04-15 | Teves Gmbh Alfred | Bremsanlage mit blockierschutz und antriebsschlupfregelung |
| DE69229219T2 (de) * | 1991-10-16 | 1999-11-04 | Biomaterial Res Inst Co Ltd | Neuartige, physiologisch aktive substanz epimorphin, für sie kodierende gene und antikörper gegen epimorphin |
| DE4139001A1 (de) | 1991-11-27 | 1993-06-03 | Boehringer Mannheim Gmbh | Verfahren zur einschleusung von nukleinsaeuren in zellen |
| US5338837A (en) | 1991-12-13 | 1994-08-16 | The Trustees Of Princeton University | Glycosylated steroid derivatives for transport across biological membranes and process for making same |
| US5858784A (en) | 1991-12-17 | 1999-01-12 | The Regents Of The University Of California | Expression of cloned genes in the lung by aerosol- and liposome-based delivery |
| US5756353A (en) * | 1991-12-17 | 1998-05-26 | The Regents Of The University Of California | Expression of cloned genes in the lung by aerosol-and liposome-based delivery |
| JPH07503372A (ja) | 1992-01-23 | 1995-04-13 | バイカル・インコーポレイテッド | 生体外遺伝子導入 |
| ES2159291T3 (es) | 1992-02-24 | 2001-10-01 | Genelabs Tech Inc | Metodo y analisis de htlv-i/htlv-ii. |
| US5459030A (en) | 1992-03-02 | 1995-10-17 | Steritech, Inc. | Synthetic media compositions for inactivating bacteria and viruses in blood preparations with 8-methoxypsoralen |
| US5543507A (en) | 1992-03-05 | 1996-08-06 | Isis Pharmaceuticals, Inc. | Covalently cross-linked oligonucleotides |
| US5885970A (en) * | 1992-03-16 | 1999-03-23 | Isis Pharmaceuticals, Inc. | Antisense oligonucleotides against human protein kinase C |
| US5916807A (en) * | 1992-03-16 | 1999-06-29 | Isis Pharmaceuticals, Inc. | Antisense oligonucleotides against human protein kinase C |
| DE69333434T2 (de) * | 1992-04-03 | 2005-03-03 | The Regents Of The University Of California, Oakland | Selbstorganisierendes system zur verabreichung von polynukleotiden enthaltend ein amphiphatisches peptid |
| US6113946A (en) | 1992-04-03 | 2000-09-05 | The Regents Of The University Of California | Self-assembling polynucleotide delivery system comprising dendrimer polycations |
| CA2094341A1 (en) | 1992-04-28 | 1993-10-29 | Carl W. Porter | Methods for the use of spermidine/spermine n1-acetyltransferase as a prognostic indicator and/or tumor response marker |
| CA2134773A1 (en) | 1992-06-04 | 1993-12-09 | Robert J. Debs | Methods and compositions for in vivo gene therapy |
| ATE282695T1 (de) | 1992-07-20 | 2004-12-15 | Isis Pharmaceuticals Inc | Pseudo-halbknoten ausbildende rna durch hybridisierung von antisenseoligonnukleotiden an gezielte rna sekundärstrukturen |
| AU678769B2 (en) | 1992-07-27 | 1997-06-12 | Hybridon, Inc. | Oligonucleotide alkylphosphonothioates |
| AU672824B2 (en) * | 1992-08-20 | 1996-10-17 | E.I. Du Pont De Nemours And Company | Crosslinked polymeric ammonium salts |
| IL106760A (en) | 1992-08-25 | 1999-12-31 | Miles Inc | Nuclear Acid Protein Hybrid Structure for Transferring Nucleic Acid from External Source to Cell and Target Nucleus |
| US5334761A (en) | 1992-08-28 | 1994-08-02 | Life Technologies, Inc. | Cationic lipids |
| US5414074A (en) | 1992-09-25 | 1995-05-09 | University Of Michigan | Synthesis of C-glycosylated compounds with the use of a mild, iodine-catalyzed reaction |
| WO1994007906A1 (en) * | 1992-10-01 | 1994-04-14 | Board Of Regents, The University Of Texas System | Epidermal surface antigen and uses thereof |
| AU678415B2 (en) | 1992-10-05 | 1997-05-29 | Hybridon, Inc. | Therapeutic anti-HIV oligonucleotide and pharmaceutical |
| US5985558A (en) * | 1997-04-14 | 1999-11-16 | Isis Pharmaceuticals Inc. | Antisense oligonucleotide compositions and methods for the inibition of c-Jun and c-Fos |
| US5266106A (en) | 1992-10-22 | 1993-11-30 | Xerox Corporation | Ink compositions with dendrimer grafts |
| US5574142A (en) | 1992-12-15 | 1996-11-12 | Microprobe Corporation | Peptide linkers for improved oligonucleotide delivery |
| JPH08501799A (ja) | 1992-12-21 | 1996-02-27 | タノックス バイオシステムズ インコーポレイテッド | アレルゲン特異的IgAモノクローナル抗体及びアレルギー治療のための関連物質 |
| US5350672A (en) | 1993-01-22 | 1994-09-27 | Kansas State University Research Foundation | Specific DNA primers and method to use same detect Eperythrozoon suis |
| CN1121721A (zh) | 1993-01-25 | 1996-05-01 | 海布里顿公司 | 寡核苷酸烷基膦酸酯和烷基硫代膦酸酯 |
| US5532142A (en) | 1993-02-12 | 1996-07-02 | Board Of Regents, The University Of Texas System | Method of isolation and purification of fusion polypeptides |
| US5436149A (en) | 1993-02-19 | 1995-07-25 | Barnes; Wayne M. | Thermostable DNA polymerase with enhanced thermostability and enhanced length and efficiency of primer extension |
| US6103492A (en) | 1993-03-08 | 2000-08-15 | Indiana University | Polynucleotide encoding mu opioid receptor |
| DE4311651A1 (de) * | 1993-04-08 | 1994-10-13 | Boehringer Ingelheim Int | Virus für den Transport von Fremd-DNA in höhere eukaryotische Zellen |
| AU6568594A (en) | 1993-04-14 | 1994-11-08 | Boehringer Mannheim Gmbh | Nucleic acid tranfer peptides and their use for injecting nucleic acids into eucaryotic cells |
| WO1994026304A1 (en) * | 1993-05-18 | 1994-11-24 | Ohio State Research Foundation | Otitis media vaccine |
| AU7097494A (en) * | 1993-06-01 | 1994-12-20 | Targeted Genetics Corporation | Envelope fusion vectors for use in gene delivery |
| EP1624068A1 (de) * | 1993-06-01 | 2006-02-08 | Life Technologies Inc. | Genetische Impfung mit kationischen Lipidstoffen |
| DK0702728T3 (da) | 1993-06-09 | 1998-06-02 | Gamera Bioscience Corp | Magnetisk cyklusreaktion |
| US5578475A (en) * | 1993-07-12 | 1996-11-26 | Life Technologies, Inc. | Composition and methods for transfecting eukaryotic cells |
| ES2211882T3 (es) | 1993-07-14 | 2004-07-16 | The Regents Of The University Of California | Sistema de cesion de polinucleotido, automontable que comprende policationes de dendrimeros. |
| US5500356A (en) | 1993-08-10 | 1996-03-19 | Life Technologies, Inc. | Method of nucleic acid sequence selection |
| US5510239A (en) | 1993-10-18 | 1996-04-23 | Isis Pharmaceuticals, Inc. | Oligonucleotide modulation of multidrug resistance-associated protein |
| AU688428B2 (en) | 1993-11-09 | 1998-03-12 | Johns Hopkins University, The | Generation of high titers of recombinant AAV vectors |
| DE4340467C2 (de) | 1993-11-27 | 2002-03-14 | Bosch Gmbh Robert | Mit Fremdkraft arbeitende hydraulische Fahrzeugbremsanlage |
| US5578716A (en) * | 1993-12-01 | 1996-11-26 | Mcgill University | DNA methyltransferase antisense oligonucleotides |
| US5556772A (en) | 1993-12-08 | 1996-09-17 | Stratagene | Polymerase compositions and uses thereof |
| DE69412518T2 (de) * | 1993-12-15 | 1999-01-28 | Kao Corp | Aminderivate und diese enthaltende waschmittelzusammensetzungen |
| US5674908A (en) * | 1993-12-20 | 1997-10-07 | Life Technologies, Inc. | Highly packed polycationic ammonium, sulfonium and phosphonium lipids |
| US5519134A (en) | 1994-01-11 | 1996-05-21 | Isis Pharmaceuticals, Inc. | Pyrrolidine-containing monomers and oligomers |
| US5484702A (en) | 1994-01-27 | 1996-01-16 | Research Foundation Of The State University Of New York At Buffalo | Method for preselecting recombinant clones containing a specific nucleic acid sequence and subsequent transformation with preselected clones |
| DE69515645T2 (de) * | 1994-01-28 | 2000-09-21 | Targeted Genetics Corp | Cd69 - transkriptionsregulierende elemente |
| DE69531487T2 (de) | 1994-01-31 | 2004-06-17 | The Regents Of The University Of California, Oakland | Methode zur eliminierung von sequenzierartefakten |
| US5928944A (en) | 1994-02-04 | 1999-07-27 | The United States Of America As Represented By The Department Of Health And Human Services | Method of adenoviral-medicated cell transfection |
| US6075012A (en) * | 1994-02-11 | 2000-06-13 | Life Technologies, Inc. | Reagents for intracellular delivery of macromolecules |
| US6989434B1 (en) | 1994-02-11 | 2006-01-24 | Invitrogen Corporation | Reagents for intracellular delivery of macromolecules |
| US5512462A (en) | 1994-02-25 | 1996-04-30 | Hoffmann-La Roche Inc. | Methods and reagents for the polymerase chain reaction amplification of long DNA sequences |
| IL128775A (en) * | 1994-03-07 | 2001-05-20 | Dow Chemical Co | A preparation containing a dendritic polymer in a complex with at least one unit of biological reaction sub |
| US5596091A (en) | 1994-03-18 | 1997-01-21 | The Regents Of The University Of California | Antisense oligonucleotides comprising 5-aminoalkyl pyrimidine nucleotides |
| US5651981A (en) | 1994-03-29 | 1997-07-29 | Northwestern University | Cationic phospholipids for transfection |
| DE4411594C1 (de) | 1994-03-30 | 1995-12-14 | Deutsches Rheumaforschungszent | Testkit zur Bestimmung von Histokompatibilitäts-Antigenen |
| DE4411588C1 (de) | 1994-03-30 | 1995-09-28 | Deutsches Rheuma Forschungszen | Puffer für DNA- und RNA-Polymerase-Reaktionen |
| US5648211A (en) | 1994-04-18 | 1997-07-15 | Becton, Dickinson And Company | Strand displacement amplification using thermophilic enzymes |
| FR2719316B1 (fr) | 1994-04-28 | 1996-05-31 | Idm | Nouveaux complexes d'acide nucléique et de polymère, leur procédé de préparation et leur utilisation pour la transfection de cellules. |
| US5670347A (en) | 1994-05-11 | 1997-09-23 | Amba Biosciences Llc | Peptide-mediated gene transfer |
| US5554746A (en) | 1994-05-16 | 1996-09-10 | Isis Pharmaceuticals, Inc. | Lactam nucleic acids |
| US5807746A (en) * | 1994-06-13 | 1998-09-15 | Vanderbilt University | Method for importing biologically active molecules into cells |
| US6495518B1 (en) * | 1994-06-13 | 2002-12-17 | Vanderbilt University | Method for importing biologically active molecules into cells |
| US5510476A (en) | 1994-07-07 | 1996-04-23 | Isis Pharmaceuticals, Inc. | Carbocation scavenging during oligonucleotide synthesis |
| US5777153A (en) | 1994-07-08 | 1998-07-07 | Gilead Sciences, Inc. | Cationic lipids |
| US5908635A (en) * | 1994-08-05 | 1999-06-01 | The United States Of America As Represented By The Department Of Health And Human Services | Method for the liposomal delivery of nucleic acids |
| AUPM747694A0 (en) * | 1994-08-16 | 1994-09-08 | Commonwealth Scientific And Industrial Research Organisation | Delivery of nucleic acids and peptides |
| DE4432485A1 (de) | 1994-09-13 | 1996-03-14 | Nobis Labordiagnostika Gmbh | Schnelltest zur Differenzierung von Erythrozytenmerkmalen |
| US5892071A (en) * | 1994-09-30 | 1999-04-06 | The Reagents Of The University Of California | Cationic transport reagents |
| US5527928A (en) | 1994-09-30 | 1996-06-18 | Nantz; Michael H. | Cationic transport reagents |
| US5837533A (en) * | 1994-09-28 | 1998-11-17 | American Home Products Corporation | Complexes comprising a nucleic acid bound to a cationic polyamine having an endosome disruption agent |
| US5753613A (en) * | 1994-09-30 | 1998-05-19 | Inex Pharmaceuticals Corporation | Compositions for the introduction of polyanionic materials into cells |
| US5785992A (en) * | 1994-09-30 | 1998-07-28 | Inex Pharmaceuticals Corp. | Compositions for the introduction of polyanionic materials into cells |
| US5912155A (en) | 1994-09-30 | 1999-06-15 | Life Technologies, Inc. | Cloned DNA polymerases from Thermotoga neapolitana |
| US5614365A (en) | 1994-10-17 | 1997-03-25 | President & Fellow Of Harvard College | DNA polymerase having modified nucleotide binding site for DNA sequencing |
| US5627159A (en) | 1994-10-27 | 1997-05-06 | Life Technologies, Inc. | Enhancement of lipid cationic transfections in the presence of serum |
| US5587441A (en) | 1994-11-08 | 1996-12-24 | Cornell Research Foundation, Inc. | Hyperbranched polymers from AB monomers |
| WO1996015811A1 (en) | 1994-11-17 | 1996-05-30 | Imperial College Of Science, Technology & Medicine | Internalisation of dna, using conjugates of poly-l-lysine and an integrin receptor ligand |
| US5840710A (en) * | 1994-12-09 | 1998-11-24 | Genzyme Corporation | Cationic amphiphiles containing ester or ether-linked lipophilic groups for intracellular delivery of therapeutic molecules |
| US6071890A (en) | 1994-12-09 | 2000-06-06 | Genzyme Corporation | Organ-specific targeting of cationic amphiphile/DNA complexes for gene therapy |
| US5948767A (en) * | 1994-12-09 | 1999-09-07 | Genzyme Corporation | Cationic amphiphile/DNA complexes |
| US5650096A (en) | 1994-12-09 | 1997-07-22 | Genzyme Corporation | Cationic amphiphiles for intracellular delivery of therapeutic molecules |
| US5719131A (en) * | 1994-12-09 | 1998-02-17 | Genzyme Corporation | Cationic amphiphiles containing dialkylamine lipophilic groups for intracellular delivery of therapeutic molecules |
| US5635487A (en) | 1994-12-29 | 1997-06-03 | Wolff; Jon A. | Amphipathic, micellar delivery systems for biologically active polyions |
| DK0805876T3 (da) * | 1995-01-19 | 2000-11-06 | Gen Probe Inc | Nukleinsyreamplifikationsoligonukleotider og prober til Lyme-sygdom-associeret Borrelia |
| US5795587A (en) | 1995-01-23 | 1998-08-18 | University Of Pittsburgh | Stable lipid-comprising drug delivery complexes and methods for their production |
| US5830430A (en) * | 1995-02-21 | 1998-11-03 | Imarx Pharmaceutical Corp. | Cationic lipids and the use thereof |
| CA2216284A1 (en) | 1995-03-23 | 1996-09-26 | Hybridon, Inc. | Thiono triester modified antisense oligodeoxynucleotide phosphorothioates |
| WO1996031549A1 (de) | 1995-04-07 | 1996-10-10 | Mueller Egbert | Dendrimere pfropfpolymerisate |
| US6372427B1 (en) | 1995-04-12 | 2002-04-16 | Hybridon, Inc. | Cooperative oligonucleotides |
| US5804376A (en) * | 1995-05-02 | 1998-09-08 | Incyte Pharmaceuticals, Inc. | Pancreas-derived serpin |
| AU5741396A (en) | 1995-05-11 | 1996-11-29 | Hybridon, Inc. | Pyrimidine targeting hairpin triplex-forming oligonucleotide s |
| US5693773A (en) * | 1995-06-07 | 1997-12-02 | Hybridon Incorporated | Triplex-forming antisense oligonucleotides having abasic linkers targeting nucleic acids comprising mixed sequences of purines and pyrimidines |
| US5705385A (en) * | 1995-06-07 | 1998-01-06 | Inex Pharmaceuticals Corporation | Lipid-nucleic acid particles prepared via a hydrophobic lipid-nucleic acid complex intermediate and use for gene transfer |
| WO1996040961A1 (en) | 1995-06-07 | 1996-12-19 | Life Technologies, Inc. | Peptide-enhanced cationic lipid transfections |
| US5830878A (en) * | 1995-06-07 | 1998-11-03 | Megabios Corporation | Cationic lipid: DNA complexes for gene targeting |
| AU723163B2 (en) * | 1995-06-07 | 2000-08-17 | Tekmira Pharmaceuticals Corporation | Lipid-nucleic acid particles prepared via a hydrophobic lipid-nucleic acid complex intermediate and use for gene transfer |
| US6051429A (en) * | 1995-06-07 | 2000-04-18 | Life Technologies, Inc. | Peptide-enhanced cationic lipid transfections |
| US20030069173A1 (en) * | 1998-03-16 | 2003-04-10 | Life Technologies, Inc. | Peptide-enhanced transfections |
| US5908777A (en) * | 1995-06-23 | 1999-06-01 | University Of Pittsburgh | Lipidic vector for nucleic acid delivery |
| DE19523516C1 (de) | 1995-06-30 | 1996-10-31 | Asta Medica Ag | Inhalator zum Verabreichen von Medikamenten aus Blisterpackungen |
| US6184038B1 (en) | 1995-07-28 | 2001-02-06 | Marie Curie Cancer Care | Transport proteins and their uses |
| US5948614A (en) | 1995-09-08 | 1999-09-07 | Life Technologies, Inc. | Cloned DNA polymerases from thermotoga maritima and mutants thereof |
| US5744335A (en) * | 1995-09-19 | 1998-04-28 | Mirus Corporation | Process of transfecting a cell with a polynucleotide mixed with an amphipathic compound and a DNA-binding protein |
| US5869715A (en) * | 1995-09-27 | 1999-02-09 | The Reagents Of The University Of California | Polyfunctional cationic cytofectins |
| US6086913A (en) | 1995-11-01 | 2000-07-11 | University Of British Columbia | Liposomal delivery of AAV vectors |
| US5595096A (en) | 1996-01-04 | 1997-01-21 | Coffman; George L. | English-metric wrench socket or drive |
| US6126964A (en) * | 1996-01-04 | 2000-10-03 | Mirus Corporation | Process of making a compound by forming a polymer from a template drug |
| AUPN741696A0 (en) * | 1996-01-05 | 1996-01-25 | Commonwealth Scientific And Industrial Research Organisation | Delivery of nucleic acids ii |
| US5962533A (en) * | 1996-02-06 | 1999-10-05 | University Of Florida Research Foundation, Inc. | Hydroxy polyamines |
| US5783566A (en) * | 1996-05-10 | 1998-07-21 | California Institute Of Technology | Method for increasing or decreasing transfection efficiency |
| WO1997042819A1 (en) * | 1996-05-13 | 1997-11-20 | Alberto Haces | Cationic lipids for transfection of negatively charged or neutral molecules into living cells |
| US5935936A (en) * | 1996-06-03 | 1999-08-10 | Genzyme Corporation | Compositions comprising cationic amphiphiles and co-lipids for intracellular delivery of therapeutic molecules |
| US6072041A (en) | 1996-06-03 | 2000-06-06 | Case Western Reserve University | Fusion proteins for protein delivery |
| US5871929A (en) * | 1996-07-23 | 1999-02-16 | Barnes; Wayne M. | Suppression of pyrophosphorolysis in DNA sequencing and in other applications involving DNA replication |
| US6013488A (en) | 1996-07-25 | 2000-01-11 | The Institute Of Physical And Chemical Research | Method for reverse transcription |
| EP0942917B1 (de) | 1996-08-14 | 2015-02-25 | Life Technologies Corporation | Verwendung von stabile zubereitungen in nukleinsäureamplifikation und sequenzierung verfahren |
| US5886165A (en) * | 1996-09-24 | 1999-03-23 | Hybridon, Inc. | Mixed backbone antisense oligonucleotides containing 2'-5'-ribonucleotide- and 3'-5'-deoxyribonucleotides segments |
| US5861397A (en) | 1996-10-03 | 1999-01-19 | Vical Incorporated | Piperazine based cytofectins |
| CA2217550A1 (en) * | 1996-10-22 | 1998-04-22 | F. Hoffmann-La Roche Ag | Cationic lipids for gene therapy |
| CA2270396C (en) * | 1996-11-04 | 2008-03-11 | Qiagen Gmbh | Cationic reagents for transfection |
| US6017735A (en) | 1997-01-23 | 2000-01-25 | Marie Curie Cancer Care | Materials and methods for intracellular transport and their uses |
| FR2760193B1 (fr) * | 1997-02-28 | 1999-05-28 | Transgene Sa | Lipides et complexes de lipides cationiques et de substances actives, notamment pour la transfection de cellules |
| WO1998040499A1 (en) * | 1997-03-10 | 1998-09-17 | Heather Lynn Davis | Gene delivery to mucosal epithelium for immunization or therapeutic purposes |
| US5837283A (en) * | 1997-03-12 | 1998-11-17 | The Regents Of The University Of California | Cationic lipid compositions targeting angiogenic endothelial cells |
| US6126965A (en) | 1997-03-21 | 2000-10-03 | Georgetown University School Of Medicine | Liposomes containing oligonucleotides |
| CA2287542A1 (en) | 1997-04-22 | 1998-10-29 | Life Technologies, Inc. | Methods for the production of aslv reverse transcriptases composed of multiple subunits |
| US5948925A (en) * | 1997-05-06 | 1999-09-07 | Genzyme Corporation | Cationic amphiphiles containing linkers derived from neutral or positively charged amino acids |
| AU3659497A (en) | 1997-07-11 | 1999-02-08 | Canji, Inc. | Organ-specific targeting of cationic amphiphile/retinobl astoma encoding dna complexes for gene therapy |
| US6025140A (en) | 1997-07-24 | 2000-02-15 | Perseptive Biosystems, Inc. | Membrane-permeable constructs for transport across a lipid membrane |
| US5877309A (en) * | 1997-08-13 | 1999-03-02 | Isis Pharmaceuticals, Inc. | Antisense oligonucleotides against JNK |
| GB9718609D0 (en) | 1997-09-02 | 1997-11-05 | Imp College Innovations Ltd | Fusion protein |
| US6093564A (en) * | 1997-10-03 | 2000-07-25 | V.I. Technologies, Inc. | Methods and compositions for the selective modification of nucleic acids |
| GB9723825D0 (en) | 1997-11-11 | 1998-01-07 | Actinova Ltd | Nuclear targeting by means of bacterial proteins |
| GB9726073D0 (en) * | 1997-12-09 | 1998-02-04 | Smithkline Beecham Plc | Novel compounds |
| US6343516B1 (en) * | 1998-01-16 | 2002-02-05 | Texaco Inc. | Multiphase flow sampling using an autotraversing sample probe |
| IL123256A0 (en) | 1998-02-10 | 1998-09-24 | Yeda Res & Dev | Methods for dna amplification and sequencing |
| US6787305B1 (en) | 1998-03-13 | 2004-09-07 | Invitrogen Corporation | Compositions and methods for enhanced synthesis of nucleic acid molecules |
| CA2327465C (en) | 1998-04-08 | 2009-12-22 | Celltech Therapeutics Limited | Bipolar lipids capable of delivering polyanions to cells |
| AU5588199A (en) | 1998-08-27 | 2000-03-21 | Alberto Haces | Novel polycationic lipids |
| AT409631B (de) * | 1998-10-28 | 2002-09-25 | Solutia Austria Gmbh | Ionisch oder nichtionisch stabilisierte epoxidaddukte als wasserverdünnbare basisharze für 2 k-isocyanat systeme |
| EP1129064B1 (de) | 1998-11-12 | 2008-01-09 | Invitrogen Corporation | Transportreagentien |
| US6355199B1 (en) * | 1999-02-12 | 2002-03-12 | St. Assembly Test Services Pte Ltd | Method of molding flexible circuit with molded stiffener |
| US7074556B2 (en) | 1999-03-02 | 2006-07-11 | Invitrogen Corporation | cDNA synthesis improvements |
| US6773920B1 (en) * | 1999-03-31 | 2004-08-10 | Invitrogen Corporation | Delivery of functional protein sequences by translocating polypeptides |
| AU775001B2 (en) | 1999-03-31 | 2004-07-15 | Invitrogen Corporation | Delivery of functional protein sequences by translocating polypeptides |
| ES2288472T3 (es) | 1999-04-26 | 2008-01-16 | Ucb Pharma, S.A. | Lipidos bipolares y su uso para la liberacion de sustancias bioactivas. |
| US6830902B1 (en) | 1999-07-02 | 2004-12-14 | Invitrogen Corporation | Compositions and methods for enhanced sensitivity and specificity of nucleic acid synthesis |
| US6211140B1 (en) | 1999-07-26 | 2001-04-03 | The Procter & Gamble Company | Cationic charge boosting systems |
| CA2405768A1 (en) * | 2000-04-12 | 2001-10-25 | Dana-Farber Cancer Institute | Self-extinguishing recombinases, nucleic acids encoding them and methods of using the same |
| AU2002232387A1 (en) | 2000-10-27 | 2002-05-06 | Invitrogen Corporation | Method for introducing antisense oligonucleotides into eucaryotic cells |
| EP1275735A1 (de) | 2001-07-11 | 2003-01-15 | Roche Diagnostics GmbH | Zusammensetzung und Methode zur 'Hot start' Nukleinsäureamplifizierung |
| US6766777B2 (en) * | 2002-06-14 | 2004-07-27 | Borgwarner, Inc. | Method to ensure robust operation of a pin lock in a vane style cam phaser |
| EP1587908A4 (de) * | 2003-01-09 | 2008-02-20 | Invitrogen Corp | Zelluläre zuführung und aktivierung von polypeptid-nukleinsäurekomplexen |
| EP1628647A4 (de) * | 2003-05-22 | 2007-10-24 | Molecular Transfer Inc | Neue lipide zur transfektion von nukleinsäuren |
| DE102006033091A1 (de) | 2006-07-14 | 2008-01-24 | Bayer Cropscience Ag | Verfahren zum Herstellen von in 1'-Stellung unverzweigten Alkenylnitrobenzolderivaten |
| GB2466305B (en) | 2008-12-19 | 2015-06-03 | Autoflame Eng Ltd | Burner installation |
-
1999
- 1999-11-12 EP EP99971794A patent/EP1129064B1/de not_active Expired - Lifetime
- 1999-11-12 WO PCT/US1999/026825 patent/WO2000027795A1/en active IP Right Grant
- 1999-11-12 DK DK99971794T patent/DK1129064T3/da active
- 1999-11-12 AU AU14776/00A patent/AU772847B2/en not_active Expired
- 1999-11-12 NZ NZ512244A patent/NZ512244A/en unknown
- 1999-11-12 JP JP2000580975A patent/JP4854853B2/ja not_active Expired - Lifetime
- 1999-11-12 EP EP10153820A patent/EP2298728A1/de not_active Withdrawn
- 1999-11-12 PT PT99971794T patent/PT1129064E/pt unknown
- 1999-11-12 EP EP20070110415 patent/EP1829856A3/de not_active Withdrawn
- 1999-11-12 AT AT99971794T patent/ATE383331T1/de active
- 1999-11-12 DE DE69937964T patent/DE69937964T2/de not_active Expired - Lifetime
- 1999-11-12 US US09/438,365 patent/US7166745B1/en not_active Expired - Lifetime
- 1999-11-12 ES ES99971794T patent/ES2296419T3/es not_active Expired - Lifetime
- 1999-11-12 CA CA2350882A patent/CA2350882C/en not_active Expired - Lifetime
-
2003
- 2003-07-28 US US10/629,522 patent/US7173154B2/en not_active Expired - Lifetime
-
2005
- 2005-01-21 US US11/040,687 patent/US7479573B2/en not_active Expired - Lifetime
- 2005-01-21 US US11/040,562 patent/US7145039B2/en not_active Expired - Lifetime
- 2005-01-21 US US11/040,449 patent/US20050164971A1/en not_active Abandoned
- 2005-01-21 US US11/040,662 patent/US7601872B2/en not_active Expired - Fee Related
-
2006
- 2006-12-28 US US11/617,614 patent/US7323594B2/en not_active Expired - Lifetime
- 2006-12-28 US US11/617,625 patent/US7470817B2/en not_active Expired - Fee Related
-
2008
- 2008-02-26 CY CY20081100221T patent/CY1107895T1/el unknown
-
2009
- 2009-01-14 US US12/353,371 patent/US8158827B2/en not_active Expired - Lifetime
- 2009-12-15 US US12/638,336 patent/US7915450B2/en not_active Expired - Fee Related
-
2011
- 2011-01-26 JP JP2011013897A patent/JP2011121966A/ja active Pending
-
2012
- 2012-03-14 US US13/420,091 patent/US8785200B2/en not_active Expired - Fee Related
-
2014
- 2014-07-21 US US14/336,887 patent/US9358300B2/en not_active Expired - Fee Related
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| DE69937964T2 (de) | Transportreagentien | |
| DE69732037T2 (de) | Cytofectine abgeleitet von piperazin | |
| DE69832293T2 (de) | Zubereitungen zur abgabe von negativ geladenen molekülen | |
| DE60126801T2 (de) | Lipidformulierungen zur zielgerichteten abgabe | |
| DE69735382T2 (de) | Kationische reagenzien zür transfektion | |
| DE69433532T2 (de) | Amphiphile imidazolinium-derivate | |
| DE69926615T2 (de) | Lipidabkömmlinge von pentaerythritol | |
| WO1997030170A1 (de) | Zusammensetzung für die transfektion höherer eukaryotischer zellen | |
| DE19607686A1 (de) | Neue metabolisierbare Lipopolyamine, deren Darstellung und Anwendung | |
| EP1003711B1 (de) | Neue lipopolyamine, deren darstellung und anwendung | |
| DE69928679T2 (de) | Kationische dendrimer-verbindungen und deren verwendung als oligonucleotid/polynucleotid-träger | |
| DE69531402T2 (de) | Kationische transport-reagenzien | |
| DE19834683A1 (de) | Neue Lipopolyamine, deren Darstellung und Anwendung | |
| DE10064870B4 (de) | Schwefelhaltige Amphiphile für den Transfer von biologisch aktiven Molekülen in Zellen |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| 8364 | No opposition during term of opposition | ||
| 8327 | Change in the person/name/address of the patent owner |
Owner name: LIFE TECHNOLOGIES CORP. (N.D.GES.D. STAATES DE, US |